题目内容
【题目】已知反应:①KClO3 + HCl-----Cl2↑+ KCl + H2O
②Cl2+2KI═2KCl+I2
③I2+5Cl2+6H2O═2HIO3+10HCl
回答下列问题:
(1)反应③中氧化产物是__________(填化学式)
(2)配平反应①并用单线桥法表示该反应中电子转移的方向和数目___KClO3 + ___HCl=_____Cl2↑+____ KCl + ____H2O,______________。
(3)下列说法正确的是______。
A. 反应③中氧化剂和还原剂的物质的量之比为1:5
B.结合反应②③,若将Cl2通入含有淀粉的KI溶液中,可能会观察到先变蓝后褪色
C.还原性由强到弱顺序:Cl-> I-
D.氧化性由强到弱顺序:KClO3>Cl2>I2
(4)实验室用反应①可以制取Cl2,若反应消耗24.5g KClO3,则至少需用________mL 6mol/LNaOH溶液吸收产生的氯气。写出吸收氯气的离子方程式:______________。
【答案】HIO3 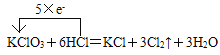 BD 200mL Cl2+2OH-=Cl-+ClO-+H2O
BD 200mL Cl2+2OH-=Cl-+ClO-+H2O
【解析】
(1)在③I2+5Cl2+6H2O═2HIO3+10HCl反应中,I2失去电子,被氧化变为HIO3,所以I2是还原剂,HIO3是氧化产物;
(2) 在①中,Cl元素的化合价由KClO3中的+5价变为Cl2中的0价,化合价降低,获得5e-,Cl元素的化合价由HCl中的-1价变为Cl2中的0价,化合价升高,失去5×e-,所以KClO3系数是1,KCl系数是1,Cl2系数是3,由于还有一个Cl原子化合价没变,反应后仍然是-1价,与K+结合,所以HCl系数是5+1=6,根据H原子守恒,可得H2O的系数是3,配平后的方程式是KClO3+6HCl=KCl+3Cl2↑+3H2O;用单线桥法表示该反应中电子转移的方向和数目是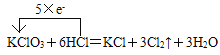 ;
;
(3)A.在③I2+5Cl2+6H2O═2HIO3+10HCl中,I2作还原剂失去电子,Cl2作氧化剂获得电子,氧化剂和还原剂的物质的量之比为5:1,A错误;
B.根据②③可知,当向含有淀粉的KI溶液中通入少量Cl2时,置换出I2,I2能使淀粉溶液变为蓝色;若Cl2过量,I2又被过量Cl2氧化产生HIO3,从而使淀粉溶液又变为无色,B正确;
C.由于氧化性:Cl2> I2,物质的氧化性越强,其相应的离子还原性就越弱,所以还原性由强到弱顺序:I- >Cl- ,C错误;
D.根据①可知氧化性:KClO3>Cl2;根据②可知氧化性:Cl2> I2,所以氧化性:KClO3>Cl2> I2,D正确;
故合理选项是BD;
(4) 用反应①KClO3+6HCl=KCl+3Cl2↑+3H2O制取氯气,n(KClO3)=![]() ,则n(Cl2)=3n(KClO3)=3×0.2mol=0.6mol;Cl2被NaOH溶液吸收,根据2NaOH+Cl2=NaCl+NaClO+H2O可知n(NaOH)=2n(Cl2)=2×0.6mol=1.2mol,则V(NaOH)=
,则n(Cl2)=3n(KClO3)=3×0.2mol=0.6mol;Cl2被NaOH溶液吸收,根据2NaOH+Cl2=NaCl+NaClO+H2O可知n(NaOH)=2n(Cl2)=2×0.6mol=1.2mol,则V(NaOH)=![]() =200mL;吸收氯气的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
=200mL;吸收氯气的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。

【题目】某实验小组同学做中和滴定和中和热的测定两个实验。
Ⅰ.下图是该小组同学用0.5000 mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和第1次滴定前、后盛放盐酸的滴定管中液面的位置。请回答下列问题。

(1)仪器A的名称是_______________。
(2)第1次滴定消耗标准液_________mL 。
(3)已知每次滴定操作所取待测NaOH溶液的体积均为20.00mL。第2、3、4次滴定数据如下表所示。通过计算得待测NaOH溶液的平均浓度是___________mol/L。(保留四位有效数字)
实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
2 | 20.00 | 1.20 | 21.20 |
3 | 20.00 | 2.24 | 22.26 |
4 | 20.00 | 1.50 | 21.48 |
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.向锥形瓶里注入20.00 mL待测NaOH溶液,并滴入2-3滴酚酞;
B.用标准溶液润洗酸式滴定管2-3次;
C.固定好装标准溶液的酸式滴定管,调节滴定管尖嘴使之充满溶液,管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2-3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准HCl溶液滴定至终点并记下滴定管液面刻度。
合理的操作顺序是(用序号字母填写)______________________________。
(5)如何判断到达滴定终点?_________________________________________。
(6)如果上述B步骤省略,对测定结果的影响是_________;标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是______(填“无影响”、“偏高”、“偏低”)。
Ⅱ.现用上述盐酸和已测出浓度的NaOH溶液,设计如下装置测定中和热。
将50mL盐酸与50mL NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(7)从图示看此装置存在错误,请指出_________________。
(8)当室内温度低于10℃时,对实验数据影响很大,实验测得的中和热数值偏小。其原因是___________________。
(9)如果实验测得起始温度为t1℃,反应后的最高温度为t2℃,则中和热的表达式为ΔH =___________。(中和后溶液的比热容c=4.18J/(g.℃))
(10)本次实验室内温度正常,操作无误,但是数据偏低,其原因是_________________。
【题目】下表是某城市某日空气质量报告:
污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
55 | SO2 | II | 良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
实验一:用下图所示装置进行实验。
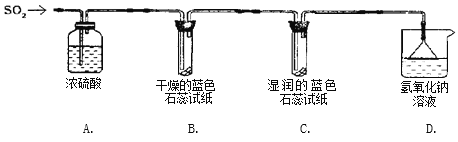
(1)A装置的作用是______________。
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变成_____色,说明SO2与水反应生成一种酸。
(3)D装置的作用是_________ ,写出反应的化学方程式_____________________________。
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的pH_______7(填“>”“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气氧化最终成_______。
(查阅资料) SO2形成酸雨的另一途径:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。在此过程中飘尘作_____。
(探究结论)SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
(1)酸雨造成的危害是:______________________________。
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为____________,是造成酸雨的另一主要原因。
(提出建议)该市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加人_________(填“水”或“乙醇”)。