题目内容
反应NH4HS(固)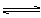 NH3(气)+H2S(气)在某温度下达到平衡,下列各种情况不能使平衡发生移动的是
NH3(气)+H2S(气)在某温度下达到平衡,下列各种情况不能使平衡发生移动的是
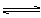 NH3(气)+H2S(气)在某温度下达到平衡,下列各种情况不能使平衡发生移动的是
NH3(气)+H2S(气)在某温度下达到平衡,下列各种情况不能使平衡发生移动的是 | A.移走一部分NH4HS |
| B.其他条件不变,通入SO2气 |
| C.容器容积不变,充入N2气 |
| D.充入N2气,保持压强不变 |
A、C
选项A中反应物NH4HS为固态,不存在浓度问题,因此多加入或取出其用量,对所发生的化学平衡体系的移动没影响。选项B,向平衡体系中通入SO2气,由于发生氧化还原反应:SO2+2H2S=3S+2H2O,降低H2S的浓度,使上述平衡体系向正反应方向移动。
选项C,容器容积不变情况下通入N2气(与此反应无关的气体),虽然容器内的压强增大了,但由于容器容积没变,原平衡体系各组分的浓度都没变,因此平衡不移动。
选项D充入N2气,为了保持容器内压强不变,势必要扩大容器的容积,但扩大容积的结果,使平衡体系里各组成成分的浓度都变小,则使原平衡状态要向气体体积增大(即向正反应)方向移动。
选项C,容器容积不变情况下通入N2气(与此反应无关的气体),虽然容器内的压强增大了,但由于容器容积没变,原平衡体系各组分的浓度都没变,因此平衡不移动。
选项D充入N2气,为了保持容器内压强不变,势必要扩大容器的容积,但扩大容积的结果,使平衡体系里各组成成分的浓度都变小,则使原平衡状态要向气体体积增大(即向正反应)方向移动。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 pC(g)
pC(g)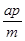 +b=p
+b=p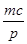 +a=m,
+a=m,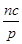 +b=n
+b=n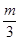 ,b=
,b=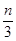 ,c=
,c=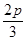

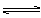 H2O(气)+CO
H2O(气)+CO 2Z(g)。已知X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,当反应在一定条件下达到平衡时各物质浓度可能是( )
2Z(g)。已知X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,当反应在一定条件下达到平衡时各物质浓度可能是( )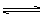 cC(气)+dD(气),达到平衡时测得B气体的浓度为0.6mol·L-1,恒温下将密闭容器的容积扩大1倍,重新达到平衡时,测得B气体的浓度为0.4mol·L-1,下列叙述中正确的是
cC(气)+dD(气),达到平衡时测得B气体的浓度为0.6mol·L-1,恒温下将密闭容器的容积扩大1倍,重新达到平衡时,测得B气体的浓度为0.4mol·L-1,下列叙述中正确的是 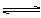 H2(气)+Br2(气)-Q达到平衡时,要使混合气体颜色加深,可采用的方法是
H2(气)+Br2(气)-Q达到平衡时,要使混合气体颜色加深,可采用的方法是 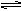 PC(g)达到化学平衡时,缩小密闭容器的体积,发现A的转化率降低,下列关系普遍运用于上述一类反应的是( )
PC(g)达到化学平衡时,缩小密闭容器的体积,发现A的转化率降低,下列关系普遍运用于上述一类反应的是( )