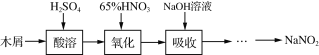
题目内容
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
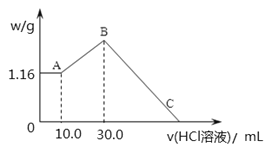
①A点的沉淀物的化学式为 。
②写出A点至B点发生反应的离子方程式: 。
③原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的
体积为 mL。
【答案】(1)Mg(OH)2
(2)AlO2-+H++H2O= Al(OH)3↓
(3)5.20;130
【解析】
试题分析:
①向水中有沉淀物组成的混合溶液中加入盐酸时,0-A时没有沉淀生成,说明溶液中NaOH过量,溶液
中铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2。
故答案:Mg(OH)2;
②A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为:H2O+AlO2-+H+=Al(OH)3↓,
故答案:H2O+AlO2-+H+=Al(OH)3↓;
③A点沉淀的是氢氧化镁,则n[Mg(OH)2]=![]() =0.02mol,根据Mg原子守恒得n(MgCl2)=
=0.02mol,根据Mg原子守恒得n(MgCl2)=
n[Mg(OH)2]=0.02mol;A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+
AlO2-+H+=Al(OH)3↓,根据HCl的体积知,n(AlO2-)=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol;根据铝
原子守恒得n(AlCl3)= n(AlO2-)=0.02mol,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)
=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.02mol×2+0.02mol×3+0.03L×1mol/L=0.13mol,氢氧化钠的质
量m(NaOH)==0.13mol×40g/mol=5.2g;C点溶液为MgCl2、AlCl3和NaCl混合液,C点所加盐酸用
于中和原混合物中的NaOH,此时所加盐酸物质的量:n(HCl)= n(NaOH)=0.13mol;C点所表示盐酸
的体积为:V=![]() =0.13L=130ml。
=0.13L=130ml。
故答案为:5.2;130。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案