题目内容
【题目】某学习小组通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
(1)Na2O2的电子式为 ,它与水反应的离子方程式是 。
(2)甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在:取少量溶液a,加入试剂_________(填化学式),有气体产生。
(3)乙同学查阅资料获悉:用KMnO4可以氧化H2O2 并测定其含量。取20.00 mL溶液,用稀H2SO4酸化,用0.002mol·L-1 KMnO4溶液滴定,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗10.00mL KMnO4溶液。
①实验中,滴定时KMnO4溶液应装在________(酸或碱)式滴定管中。
②用单线桥标出该反应电子转移的方向和数目: 2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O。
③溶液a中c(H2O2)=_________mol·L-1。
④溶液褪色速率后阶段变快的原因可能是____ _ _。
【答案】(1)![]() ;2Na2O2 + 2H2O =4Na+ + 4OH- + O2↑
;2Na2O2 + 2H2O =4Na+ + 4OH- + O2↑
(2)MnO2(Cu2+、Fe3+也可)
(3)①酸;②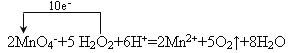 ;③0.0025;④反应生成的Mn2+作催化剂(其它合理答案也可)
;③0.0025;④反应生成的Mn2+作催化剂(其它合理答案也可)
【解析】
试题分析:(1)Na2O2属于离子化合物,电子式为![]() ,它与水反应的离子方程式为2Na2O2 + 2H2O =4Na+ + 4OH- + O2↑,故答案为:
,它与水反应的离子方程式为2Na2O2 + 2H2O =4Na+ + 4OH- + O2↑,故答案为:![]() ;2Na2O2 + 2H2O =4Na+ + 4OH- + O2↑;
;2Na2O2 + 2H2O =4Na+ + 4OH- + O2↑;
(2)能使H2O2产生气体通常用MnO2作催化剂;故答案为:MnO2;
(3)①酸性KMnO4溶液具有强氧化性,能够腐蚀橡皮管,应装在酸式滴定管中,故答案为:酸;
②2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O反应中是氧化剂,是还原剂,转移2×(7-2)=10个电子,单线桥标出该反应电子转移的方向和数目形式为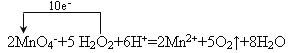 ,故答案为:
,故答案为: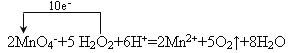 ;
;
③根据KMnO4与H2O2反应的离子方程式可知关系式为:
2MnO4-~5H2O2
2mol 5mo
0.002molL-1×0.01L n(H2O2)
∴n(H2O2)=0.5×10-4mol
∴c(H2O2)=![]() =0.0025mol/L故答案为:0.0025mol/L;
=0.0025mol/L故答案为:0.0025mol/L;
④一般情况下在开始时反应物浓度较大,反应速率应当较快,但现在是溶液褪色速率开始较慢后变快,则可能是产生新的物质,且此物质对反应有催化作用,从而加快了反应速率,根据离子反应2MnO4- + 5H2O2 + 6H+ = 2Mn2+ + 5O2↑ + 8H2O,可知,起催化作的产物为Mn2+;故答案为:反应生成的Mn2+作催化剂。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案