题目内容
【题目】下图所示的实验装置中, A、E分别为NH3和Cl2的发生装置。
请回答下列问题:
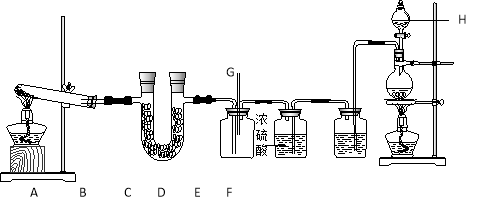
(1)装置E中发生反应的离子方程式为 。
(2)甲、乙两同学分别采用下列两种方案制取C12:甲:用含HCl 146g的浓盐酸与足量的MnO2反应。乙:用87g MnO2与足量浓盐酸反应。则所得氯气__________(填字母)。
a.甲比乙多 b.乙比甲多 c.一样多
(3)仪器H的名称是_____________(填名称) ,装置D的作用是 。
(4)装置C的导管G处逸出的尾气中可能含有黄绿色的有毒气体,可用 进行尾气处理(填选用试剂的名称)。
【答案】
(1)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O;
(2)b;
(3)分液漏斗;除去挥发出的氯化氢;
(4)氢氧化钠;
【解析】
试题分析:(1)装置E中二氧化锰与浓盐酸反应生成氯气,反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O;
(2)146g HCl的物质的量为![]() =4mol,随着反应的进行盐酸浓度逐渐降低,反应停止,因此生成的氯气属于1mol;87g MnO2的物质的量为1mol,完全反应后生成1mol Cl2,故选b;
=4mol,随着反应的进行盐酸浓度逐渐降低,反应停止,因此生成的氯气属于1mol;87g MnO2的物质的量为1mol,完全反应后生成1mol Cl2,故选b;
(3)仪器H是分液漏斗,装置D中盛放饱和食盐水,可以除去挥发出的氯化氢,故答案为:分液漏斗;除去挥发出的氯化氢;
(4)氯气的水溶液显酸性,尾气中的氯气可以用氢氧化钠除去,故答案为:氢氧化钠。

练习册系列答案
相关题目