题目内容
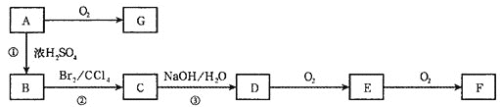
【题目】某化学实验小组同学用如图所示装置进行系列实验,以探究气体的性质(部分仪器已略去)。
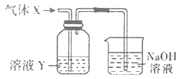
回答下列问题:
(1)若气体X为氯气,溶液Y为含有少量KSCN的FeCl2溶液,则可观察到溶液Y中的实验现象是___,写出NaOH溶液中发生反应的离子方程式:___。
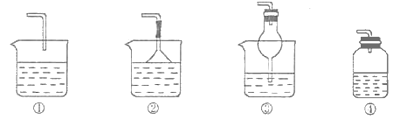
(2)若溶液Y为品红溶液,气体X通过后,溶液褪色。取少量褪色后的溶液加热后恢复为红色,则气体X可能是___(填化学式)。根据气体X的性质,上述实验装置应作一定的改进,则下列装置中可用来替代其尾气吸收装置的是___(填序号)。
【答案】溶液变为血红色 Cl2+2OH-=Cl-+ClO-+H2O; SO2 ②或③
【解析】
(1)氯气有强氧化性,能把亚铁离子氧化生成铁离子,铁离子能和硫氰根离子反应生成红色的络合物,氯气能和氢氧化钠反应生成氯化钠和次氯酸钠、水;
(2)二氧化硫能使品红溶液褪色,且褪色后的溶液加热能恢复原色;二氧化硫属于酸性氧化物,能和氢氧化钠反应,对尾气吸收实验装置应作一定的改进,应防止倒吸。
(1)氯气有强氧化性,能把亚铁离子氧化生成铁离子,离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,铁离子能和硫氰根离子反应生成红色的络合物,所以溶液呈红色,离子方程式为:Fe 3++3SCN-Fe(SCN)3,氯气能和氢氧化钠反应生成氯化钠和次氯酸钠、水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;
(2)二氧化硫能使品红溶液褪色,且褪色后的溶液加热能恢复原色,所以该气体可能是SO2,二氧化硫能与氢氧化钠反应,①④装置尾气吸收不充分,②或③在导气管中都有相对较大的空间,这样既可以充分吸收,又可以防止倒吸现象的发生。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目