题目内容
【题目】用三个集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中。分别缓慢通入适量O2或Cl2,如图所示。一段时间后,D、E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。(假设瓶内液体不扩散)

(1)写出装置E中反应的离子方程式:__________________________________________
(2)假设该实验条件下,气体摩尔体积为aL·mol-1。则装置D的集气瓶中所得溶液溶质的物质的量浓度为____________;发生反应的方程式____________________________。
(3)通入氧气前在F装置的水槽里滴加几滴紫色石蕊溶液,观察到的现象是_____________,通入氧气后,可能观察到的实验现象是_________________________________________,写出反应的总化学方程式:_________________________________________________。
【答案】Cl2+SO2+2H2O=4H++2Cl-+SO42- ![]() mol/L 4NO2+O2+2H2O=4HNO3 紫色石蕊试液变红 红色由浅变深 2SO2+O2+2H2O=2H2SO4
mol/L 4NO2+O2+2H2O=4HNO3 紫色石蕊试液变红 红色由浅变深 2SO2+O2+2H2O=2H2SO4
【解析】
(1)二氧化硫和氯气按一定比例可完全溶解于水中发生氧化还原反应生成硫酸和盐酸;
(2)氧气、二氧化氮一定比例下可完全溶于水中,反应为:4NO2+O2+2H2O=4HNO3,根据氮元素守恒,n(NO2)=n(HNO3),则所得溶液溶质的物质的量浓度为根据c=![]() 计算;
计算;
(3)F装置中二氧化硫与水反应生成亚硫酸,酸性较弱,再通入氧气,亚硫酸被氧化成硫酸,溶液酸性增强。
(1)二氧化硫和氯气按一定比例可完全溶解于水中形成溶液:Cl2+SO2+2H2O=4H++2Cl-+SO42-;
(2)水会充满集气瓶,设集气瓶体积为VL,最后溶液的体积为VL,由4NO2+O2+2H2O=4HNO3知,n(NO2)=n(HNO3),则所得溶液溶质的物质的量浓度为:c=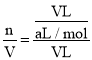 =
=![]() mol/L;
mol/L;
(3)F装置中二氧化硫与水反应生成亚硫酸,酸性溶液加入紫色石蕊试液会变红,再通入氧气,亚硫酸被氧化成硫酸,溶液酸性增强,红色由浅变深,反应的化学方程式为:2SO2+O2+2H2O=2H2SO4。

 阅读快车系列答案
阅读快车系列答案