题目内容
已知H—H键能436 kJ/mol;Cl—Cl键能243kJ/mol;H—Cl键能431 kJ/mol,则下列热化学方程式正确的是
| A.H2(g)+Cl2(g)="2HCl(g)" ΔH=-183 kJ/mol |
| B.1/2H2(g)+1/2Cl2(g)="HCl(g)" ΔH=-124kJ/mol |
| C.2HCl(g)=H2(g)+Cl2(g) ΔH=-248 kJ/mol |
| D.HCl(g) =1/2H2(g)+1/2Cl2(g) ΔH=-91.5 kJ/mol |
A
反应热就是断键吸收的能量和形成化学键所放出的能量的差值,因此生成2mol氯化氢的反应热=436 kJ/mol+243kJ/mol-431 kJ/mol×2=-183 kJ/mol,A正确,答案选A。

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
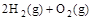 =2H2O(g);△H2=--Q2 kJ·
=2H2O(g);△H2=--Q2 kJ·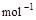 ,
, ;HCl(aq)与NaOH反应的
;HCl(aq)与NaOH反应的 ,则HCN在水溶液中电离的
,则HCN在水溶液中电离的 等于
等于

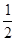 O2(g)=CO(g)
O2(g)=CO(g)  H1=-110.5 kJ/mol
H1=-110.5 kJ/mol

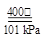 NO2(g)+CO(g)△H=+234 kJ/mol
NO2(g)+CO(g)△H=+234 kJ/mol