题目内容
化学反应N2+3H2===2NH3的能量变化如右图所示,该反应的热化学方程式是
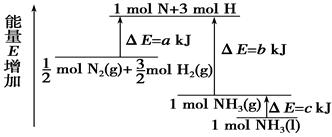

| A.N2(g)+3H2(g)===2NH3(l) ΔH=2(a-b-c)kJ·mol- |
| B.N2(g)+3H2(g)===2NH3(g) ΔH=2(b-a)kJ·mol-1 |
| C.1/2 N2 (g)+3/2H2(g)===NH3(l) ΔH=(b+c-a)kJ·mol-1 |
| D.1/2 N2(g)+3/2H2(g)===NH3(g) ΔH=(a+b)kJ·mol-1 |
A
根据图像可知,akJ是活化能。由于反应物的总能量高于生成物的总能量,所以是放热反应,方程式为1/2 N2(g)+3/2H2(g)===NH3(l) ΔH=(a-b)kJ·mol-1。如果生成气态氨气,则是1/2 N2(g)+3/2H2(g)===NH3(g) ΔH=(a-b-c)kJ·mol-1,所以正确的答案选A。

练习册系列答案
相关题目
 ===H2O(g) △H1=a kJ·
===H2O(g) △H1=a kJ·
 ===2H2O(g) △H2=b kJ·
===2H2O(g) △H2=b kJ· ===2H2O(l) △H4=d kJ·
===2H2O(l) △H4=d kJ·
 O2 (g)
O2 (g)  2SO3,当生成2 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则( )
2SO3,当生成2 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则( )