题目内容
在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中,还原剂与氧化剂的物质的量为
- A.3:8
- B.1:1
- C.3:2
- D.1:2
C
分析:根据化合价变化判断出氧化剂、还原剂,同一化学反应中,物质的量之比等于计量数之比.
解答:该反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素化合价变化为:0价→+2价,失电子作还原剂;N元素的化合价变化为:+5价→+2价,得电子作氧化剂;硝酸有一部分化合价不变化,所以还有部分硝酸只起酸作用,根据氧化还原反应中得失电子数相等知,铜全部作还原剂,有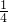 的硝酸作氧化剂,所以还原剂与氧化剂的物质的量之比为3:2.
的硝酸作氧化剂,所以还原剂与氧化剂的物质的量之比为3:2.
故选C.
点评:本题考查了氧化还原反应中氧化剂、还原剂的判断,难度不大,注意硝酸不仅作氧化剂还起酸的作用.
分析:根据化合价变化判断出氧化剂、还原剂,同一化学反应中,物质的量之比等于计量数之比.
解答:该反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素化合价变化为:0价→+2价,失电子作还原剂;N元素的化合价变化为:+5价→+2价,得电子作氧化剂;硝酸有一部分化合价不变化,所以还有部分硝酸只起酸作用,根据氧化还原反应中得失电子数相等知,铜全部作还原剂,有
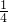 的硝酸作氧化剂,所以还原剂与氧化剂的物质的量之比为3:2.
的硝酸作氧化剂,所以还原剂与氧化剂的物质的量之比为3:2.故选C.
点评:本题考查了氧化还原反应中氧化剂、还原剂的判断,难度不大,注意硝酸不仅作氧化剂还起酸的作用.

练习册系列答案
相关题目
