��Ŀ����
����Ŀ���ס�����ͬѧ�ֱ���������̽��ʵ�顣
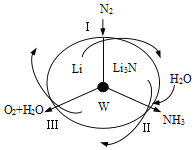
(1)����̽��![]() ��
��![]() ��Һ��Ӧ��ʵ��װ�����£�
��Һ��Ӧ��ʵ��װ�����£�

����ָ����װ�õIJ���֮�� ______ �� ______ ��
��![]() ��
��![]() ��Һ��Ӧ�����ӷ���ʽΪ ______ ��
��Һ��Ӧ�����ӷ���ʽΪ ______ ��
�����ʵ�飬����ʵ�鲽�裬֤��ϴ��ƿ�е�![]() �ѱ����� ______ ��
�ѱ����� ______ ��
(2)����̽����������![]() �е�
�е�![]() �ڲ�ͬ�¶ȡ���ͬŨ��NaOH��Һ�е�ˮ�����ʡ�ȡ��֧��С��ͬ���Թܣ����Թ������������̶�ֽ�����±����ж���ʵ�顣�����ֲ�ͬ�¶ȵ�ˮԡ�м�����ͬʱ���¼����������ȷ��ˮ�ⷴӦ������
�ڲ�ͬ�¶ȡ���ͬŨ��NaOH��Һ�е�ˮ�����ʡ�ȡ��֧��С��ͬ���Թܣ����Թ������������̶�ֽ�����±����ж���ʵ�顣�����ֲ�ͬ�¶ȵ�ˮԡ�м�����ͬʱ���¼����������ȷ��ˮ�ⷴӦ������
�Թܢ� | �Թܢ� | �Թܢ� | �Թܢ� | |
�������� | 1 | V1 | V2 | V3 |
| V4 | 3 | 0 | V5 |
����ˮ | 0 | V6 | 5 | 2 |
��������ϱ�������![]() ______ ��
______ ��![]() ______ ��
______ ��![]() ______ ��
______ ��
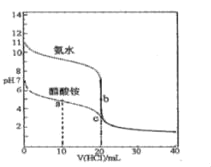
��ʵ���У����ñ���ʳ��ˮ�������ˮ�����ŵ��� ______ ���������ñ���![]() ��Һ�������ˮ����ԭ���� ______ ��
��Һ�������ˮ����ԭ���� ______ ��
��ʵ���У��Թܢ����Թܢ��е�������ٸ��죬��ԭ���У��¶ȸ����ʿ죬�������� ______��
���𰸡�û�м���װ�� û��β������װ�� ![]() ȡ����ϴ��ƿ�е�Һ���ڸɾ��Թ��У�������������
ȡ����ϴ��ƿ�е�Һ���ڸɾ��Թ��У�������������![]() �μ�ϡ���������ٲ�������
�μ�ϡ���������ٲ�������![]() ���ٵμ��������Ȼ�����Һ����������ɫ��������֤���Ѿ������� 1 5 3 �ɼ�С����������ˮ�е��ܽ�ȣ�ʹʵ������ȷ ̼������Һˮ���Լ��ԣ�������̽��NaOH��Һ��ˮ�����ʵ�Ӱ�� ˮԡ�¶Ƚӽ����������ķе㣬�¶�Խ�ߣ����������ӷ�ҲԽ�죬��������ٸ���
���ٵμ��������Ȼ�����Һ����������ɫ��������֤���Ѿ������� 1 5 3 �ɼ�С����������ˮ�е��ܽ�ȣ�ʹʵ������ȷ ̼������Һˮ���Լ��ԣ�������̽��NaOH��Һ��ˮ�����ʵ�Ӱ�� ˮԡ�¶Ƚӽ����������ķе㣬�¶�Խ�ߣ����������ӷ�ҲԽ�죬��������ٸ���
��������
(1)�ٸ���ʵ������ȡ�����ķ�Ӧԭ���������ж��ȷ�����з�����
����������ǿ�����ԣ��ܹ����������������������ƣ�
���������Ʊ������������ƣ�ͨ��������������ӿ���֤���������Ʊ�������
(2)�ܸ���ʵ��Ŀ�ġ�����̽����������![]() �е�
�е�![]() �ڲ�ͬ�¶ȡ���ͬŨ��NaOH��Һ�е�ˮ�����ʡ���������������ԭ������жϣ�
�ڲ�ͬ�¶ȡ���ͬŨ��NaOH��Һ�е�ˮ�����ʡ���������������ԭ������жϣ�
�ݸ������������ڱ���ʳ��ˮ�е��ܽ�ȼ�С���濼�ǣ�����̼������Һˮ����ʾ���Է�����
�������������ķе�Ϊ![]() ��
��![]() ʱ�����������ӷ�������
ʱ�����������ӷ�������
(1)��Ũ���������������ȡ�����ķ�Ӧ��Ҫ���ȣ������ж���Ӧ��ʹ��β������װ�ã��ʴ�Ϊ��û�м���װ�ã�û��β������װ�ã�
������������������Һ��Ӧ���������ƺ��Ȼ��⣬��Ӧ�����ӷ���ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
����ϴ��ƿ�е�![]() �ѱ���������ϴ��ƿ����Һ��Ӧ�ô�����������ӣ����鷽��Ϊ��ȡ����ϴ��ƿ�е�Һ���ڸɾ��Թ��У�������������
�ѱ���������ϴ��ƿ����Һ��Ӧ�ô�����������ӣ����鷽��Ϊ��ȡ����ϴ��ƿ�е�Һ���ڸɾ��Թ��У�������������![]() �μ�ϡ���������ٲ�������
�μ�ϡ���������ٲ�������![]() ���ٵμ��������Ȼ�����Һ����������ɫ��������֤���Ѿ����������ʴ�Ϊ��ȡ����ϴ��ƿ�е�Һ���ڸɾ��Թ��У�������������
���ٵμ��������Ȼ�����Һ����������ɫ��������֤���Ѿ����������ʴ�Ϊ��ȡ����ϴ��ƿ�е�Һ���ڸɾ��Թ��У�������������![]() �μ�ϡ���������ٲ�������
�μ�ϡ���������ٲ�������![]() ���ٵμ��������Ȼ�����Һ����������ɫ��������֤���Ѿ���������
���ٵμ��������Ȼ�����Һ����������ɫ��������֤���Ѿ���������
(2)������̽����������![]() �е�
�е�![]() �ڲ�ͬ�¶ȡ���ͬŨ��NaOH��Һ�е�ˮ�����ʣ��ĸ��Թ������������������Ӧ��Ϊ1mL������
�ڲ�ͬ�¶ȡ���ͬŨ��NaOH��Һ�е�ˮ�����ʣ��ĸ��Թ������������������Ӧ��Ϊ1mL������![]() ����ʵ��̽�������¶ȡ�NaOHŨ�ȶ���������ˮ�����ʵ�Ӱ�죬�������������Ũ��Ӧ����һ��������뱣֤��Һ�������ȣ����Թܢ��֪��Һ�����Ϊ6mL����
����ʵ��̽�������¶ȡ�NaOHŨ�ȶ���������ˮ�����ʵ�Ӱ�죬�������������Ũ��Ӧ����һ��������뱣֤��Һ�������ȣ����Թܢ��֪��Һ�����Ϊ6mL����![]() ��
��![]() ��
��![]() ���Թ�I���Թܢ��Թܢ�̽��NaOHŨ�ȶ�����������ˮ�����ʵ�Ӱ�죬�Թܢ����Թܢ�̽���¶ȶ���������ˮ�����ʵ�Ӱ�죬�ʴ�Ϊ��1��5��3��
���Թ�I���Թܢ��Թܢ�̽��NaOHŨ�ȶ�����������ˮ�����ʵ�Ӱ�죬�Թܢ����Թܢ�̽���¶ȶ���������ˮ�����ʵ�Ӱ�죬�ʴ�Ϊ��1��5��3��
���������������ڱ���ʳ��ˮ�е��ܽ�ȼ�С����ʵ���У����ñ���ʳ��ˮ�������ˮ���Ա��С����������ˮ�е��ܽ�ȣ�ʹʵ������ȷ����̼������Һˮ���Լ��ԣ�������̽��NaOH��Һ��ˮ�����ʵ�Ӱ�죬���Բ����ñ���![]() ��Һ�������ˮ���ʴ�Ϊ���ɼ�����������ˮ�е��ܽ�ȣ�ʹʵ������ȷ��̼������Һˮ���Լ��ԣ�������̽��NaOH��Һ��ˮ�����ʵ�Ӱ�죻
��Һ�������ˮ���ʴ�Ϊ���ɼ�����������ˮ�е��ܽ�ȣ�ʹʵ������ȷ��̼������Һˮ���Լ��ԣ�������̽��NaOH��Һ��ˮ�����ʵ�Ӱ�죻
�����������ķе�Ϊ![]() ��ˮԡ�¶Ƚӽ����������ķе㣬�¶�Խ�ߣ����������ӷ�ҲԽ�죬�����Թ�������������ʼӿ죬������ʵ�������ʴ�Ϊ��ˮԡ�¶Ƚӽ����������ķе㣬�¶�Խ�ߣ����������ӷ�ҲԽ�죬��������ٸ��졣
��ˮԡ�¶Ƚӽ����������ķе㣬�¶�Խ�ߣ����������ӷ�ҲԽ�죬�����Թ�������������ʼӿ죬������ʵ�������ʴ�Ϊ��ˮԡ�¶Ƚӽ����������ķе㣬�¶�Խ�ߣ����������ӷ�ҲԽ�죬��������ٸ��졣

 ����ϰ�⽭��ϵ�д�
����ϰ�⽭��ϵ�д� ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�