题目内容
【题目】工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本。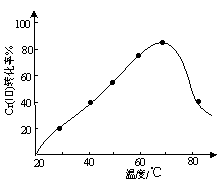
(1)工业上处理100 L Cr2O72-含量为108 mg·L-1的含铬废水,至少需要 L(标准状况)SO2。
(2)已知:Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+(使其浓度小于1×10-6 mol·L-1),需调节溶液pH 。
(3)三价铬Cr(Ⅲ)与双氧水反应可用于合成铬黄(PbCrO4)。控制其他条件不变,调节反应温度,考察反应温度对Cr(Ⅲ)转化率的影响(如图所示)。温度超过70℃时,Cr(Ⅲ)转化率下降的原因是 。
(4)光照下,草酸(H2C2O4)也能将Cr2O72-转化为Cr3+。化学式为Al2Fe(SO4)4的某发盐(毛发状,在空气中能被氧化)对该反应具有催化作用。为确定一瓶久置发盐的化学成分,学习小组进行如下实验:
取一定质量的发盐样品溶于足量的稀硫酸中,将溶液分为两等份。其中一份与酸性KMnO4溶液充分反应(反应后MnO4-被还原成Mn2+),消耗浓度为0.4000mol·L-1的KMnO4溶液20.00mL;往另一份溶液中加入足量稀氨水,在空气中微热并搅拌使之充分反应,待沉淀不再变化后过滤,将沉淀洗涤并充分灼烧后称量,得9.100g干燥固体粉末。
通过计算与合理猜想,推测该久置发盐的可能化学组成(请给出计算过程与推测理由)。
【答案】(1)3.36; (2)>6; (3)较高温度下双氧水发生分解;(4)Al10Fe5(OH)(SO4)20[或Al20Fe10(CO3)(SO4)40]。
【解析】
试题分析:(1)根据氧化还原反应得失电子数目守恒,即100×108×10-3×2×(6-3)/216=V(SO2)×2/22.4,解得V(SO2)=3.36L;(2)Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-),代入数值,求出c(OH-)=10-8mol·L-1,根据水的离子积,c(H+)=Kw/c(OH-)=10-14/10-8mol·L-1=10-6mol·L-1,即pH>6;(3)过氧化氢不稳定,受热易分解,转化率降低,可能是过氧化氢在较高温度下发生分解;(4)n(KMnO4)=0.4000 mol·L-1×20 mL×10-3L·mL-1=8.000×10-3 mol
n(Fe2+)=5×8.000×10-3 mol=0.0400 mol
根据发盐的化学式可知在久置的发盐中:n(Al3+)=2×[0.0400mol+n(Fe3+)]
加入氨水后生成的干燥固体粉末中:n(Al2O3)=0.0400mol+n(Fe3+)
n(Fe2O3)= 1×[0.0400mol+n(Fe3+)]/2
102 g·mol-1×[0.0400mol+n(Fe3+)]+160 g·mol-1×1×[0.0400mol+n(Fe3+)]/2=9.100g
n(Fe3+)=0.0100mol
n(Al3+)=2×[0.0400mol+n(Fe3+)]=0.1000mol
n(SO42-)=2n(Al3+)=0.2000mol
久置发盐中的阳离子所带电荷总数:3n(Al3+)+2n(Fe2+)+3n(Fe3+)=0.4100mol
而已知的阴离子所带电荷总数:2n(SO42-)=0.4000mol<0.4100mol
由于发盐在空气中被氧化,故其中还可能存在0.0100molOH-(或0.0050molCO32-)。
该久置发盐的可能组成为Al10Fe5(OH)(SO4)20[或Al20Fe10(CO3)(SO4)40]。

【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验中对NH3与NO2反应进行了探究。回答下列问题:
(1)氨气的制备
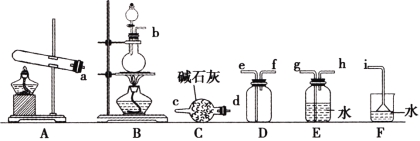
①氨气的发生装置可以选择上图中的 ,反应的化学方程式为 。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→ (按气流方向,用小写字母表示)
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2 (两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
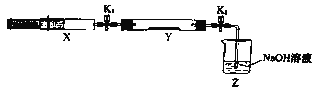
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中 | ②反应的化学方程式 |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开 | ③ | ④ |