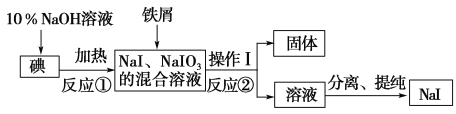
题目内容
【题目】以Pt为电极,电解含有0.10molM+和0.10molN3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如右图。对离子氧化能力的强弱判断正确的是(选项中H+为氢离子)
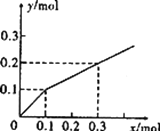
A. M+>H+>N3+
B. M+>N3+>H+
C. N3+>H+>M+
D. 条件不足,无法确定
【答案】A
【解析】试题分析:通电后就有固体生成,当通过电子为0.1mol时,析出固体或气体的物质的量为0.1mol,证明此时析出的固体,而不是氢气(若是氢气,那么氢气的物质的量应该为0.05mol),第二阶段,失去电子0.2mol,对应物质0.1mol,可知该物质是氢气,后面失电子数和物质的量比例保持不变,说明X3+不放电,M+离子先于H+放电,故氧化能力为M+>H+>N3+。故选A。

【题目】某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
实验序号 | 锌的质量/g | 锌的状态 | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 其他试剂 |
1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过测定 进行判断,其速率最快的是 (填实验序号)。
(2)实验1和2表明 对反应速率有影响;实验1和3表明 对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。
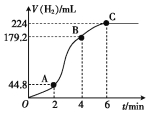
①在OA、AB、BC三段中反应速率最快的是 ,其原因是 。
②2~4 min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)v(H2SO4)= mol·L-1·min-1。