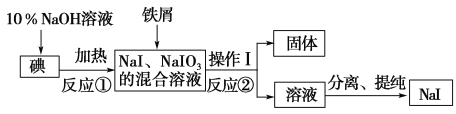
题目内容
【题目】把NaOH和Na2CO3混和物配制成100mL溶液,其中c(Na+)=0.5mol/L。在该溶液中加入过量盐酸反应完全后,将溶液蒸干后所得固体质量为
A、2.93 g B、5.85 g C、6.56g D、无法确定
【答案】A
【解析】
试题分析:在NaOH和Na2CO3混和溶液中加入过量盐酸反应完全后,将溶液蒸干后所得固体为NaCl。原溶液中n(Na+)=cV=0.5mol/L×100mL=0.05mol。根据钠元素守恒,可得n(NaCl)=n(Na+)=0.05mol,则m(NaCl)=n×M=0.05mol×58.5g/mol=2.93 g。故选A。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目