��Ŀ����
����Ŀ��A��B��C��D��E��FΪ����������Ԫ�أ���ԭ��������������A��B ��Ԫ��������ۺ������֮��Ϊ�㡣E��Aͬ����; D��F�ǵؿ��к�����ߵķǽ���Ԫ�غͽ���Ԫ�ء�
(1)д��CԪ�ص�Ԫ������____���������ڱ��е�λ��_______________��E���ӽṹʾ��ͼΪ______________��E2D2�ĵ���ʽ______________��
(2)��A��C��ԭ�Ӹ�����Ϊ5:1��ɵ�һ�ֻ�������и�ԭ�Ӿ��ﵽ�ȶ��ṹ���û�������������ѧ������Ϊ______________��
(3)F������������C ������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽΪ______________��
(4)��C��E ��ɵ�һ�����ӻ����ﻯѧʽΪE3C���û��������������ӵİ뾶��С��ϵ��______>______���û�������ˮ���ҷ�Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ______________��
���𰸡� �� ��2����VA 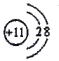
![]() ���Ӽ������ۼ� Al2O3+6H+=2Al3++3H2O N3->Na+ Na3N+3H2O=3NaOH+NH3��
���Ӽ������ۼ� Al2O3+6H+=2Al3++3H2O N3->Na+ Na3N+3H2O=3NaOH+NH3��
��������A��B��C��D��E��FΪ����������Ԫ�أ���ԭ��������������D��F�ǵؿ��к�����ߵķǽ���Ԫ�غͽ���Ԫ�أ�D��O��F��Al��A��B��Ԫ��������ۺ������֮��Ϊ�㣬A��H��B��C��C��N��E��Aͬ���壬E��Na��C��N��
(1)CԪ�ص�Ԫ�������ǵ����������ڱ��е�λ���ǵ�2����VA�塣�����ӽṹʾ��ͼΪ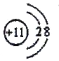 ��E2D2�ǹ������ƣ�����ʽΪ
��E2D2�ǹ������ƣ�����ʽΪ![]() ��(2)��A��C��ԭ�Ӹ�����Ϊ5:1��ɵ�һ�ֻ�������и�ԭ�Ӿ��ﵽ�ȶ��ṹ���û�������NH4H������������ѧ������Ϊ���Ӽ������ۼ���(3)F�������������������C������������Ӧ��ˮ�������ᷴӦ�����ӷ���ʽΪAl2O3+6H+=2Al3++3H2O��(4)��������Ų���ͬʱ���Ӱ뾶��ԭ���������������С�����������ӵİ뾶��С��ϵ��N3-��Na+����ˮ��Ӧ�����������ƺͰ���������ʽΪNa3N+3H2O��3NaOH+NH3����
��(2)��A��C��ԭ�Ӹ�����Ϊ5:1��ɵ�һ�ֻ�������и�ԭ�Ӿ��ﵽ�ȶ��ṹ���û�������NH4H������������ѧ������Ϊ���Ӽ������ۼ���(3)F�������������������C������������Ӧ��ˮ�������ᷴӦ�����ӷ���ʽΪAl2O3+6H+=2Al3++3H2O��(4)��������Ų���ͬʱ���Ӱ뾶��ԭ���������������С�����������ӵİ뾶��С��ϵ��N3-��Na+����ˮ��Ӧ�����������ƺͰ���������ʽΪNa3N+3H2O��3NaOH+NH3����

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�


