题目内容
【题目】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3═2A+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为________,含有的化学键类型为_________________。
(2)生成物中含有一个10个电子的分子,该分子的空间构型为________,中心原子的杂化方式为________。
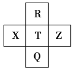
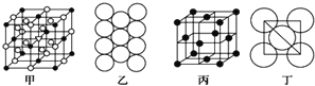
(3)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是________(填微粒符号)。
(4)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示。则一个晶胞中Al原子的数目为________个。
【答案】Na3AlF6 离子键、配位键 V形 sp3 Na+ 4
【解析】
(1)A为冰晶石,利用反应前后原子守恒、元素守恒,推出A的化学式为Na3AlF6;Na+与AlF63-之间存在离子键,Al3+与F-之间存在共价键和配位键;
(2)根据方程式,生成物中含有10电子的分子为H2O,O原子的孤电子对数为(6-2)/2=2,价层电子对数为2+2=4,H2O中O杂化类型为sp3,由于O上还有两对孤电子对,故H2O的空间构型为V型;
(3)●位于大立方体的顶点和面心,●的个数为8×1/8+6×1/2=4,○位于大立方体的12条棱的中点和8个小立方体的体心,○的个数为12×1/4+8=11,根据冰晶石的化学式,微粒个数比为3:1,则大立方体的体心为○,代表微粒为Na+;
(4)该晶胞中Al的个数为8×1/8+6×1/2=4。

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案