题目内容
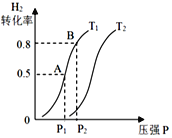
【题目】在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是

A.t时,X、Y、Z的质量不再改变
B.该反应的化学方程式为:3Z=3X+2Y
C.t时,Z的浓度为1.2mol/L
D.t时,反应停止,反应速率为0
【答案】A
【解析】
根据图象,Z的物质的量逐渐减少,X、Y的物质的量逐渐增大,说明Z为反应物,X、Y为生成物,最终达到平衡状态,说明为可逆反应,结合物质的量的变化关系判断反应的方程式,再结合化学反应速率和平衡状态的特征分析判断。
A.根据图象,t时为平衡状态,化学平衡时各组分的浓度不再随时间变化而变化,故X、Y、Z的质量也不再改变,故A正确;
B.由图可知,X、Y的物质的量增大,为生成物,Z物质的量减小,为反应物,到达平衡后,X生成1.8mol,Y生成1.2mol,Z反应1.8mol,X、Y、Z的化学计量数之比=1.8∶1.2∶1.8=3∶2∶3,则反应的化学方程式为:3Z3X+2Y,故B错误;
C.根据图象可知,平衡时Z的浓度为![]() =0.6mol/L,故C错误;
=0.6mol/L,故C错误;
D.t时为平衡状态,反应处于平衡时正、逆反应速率相等,但不等于零,故D错误;
故选A。

练习册系列答案
相关题目