题目内容
19.下列性质的比较中,正确的是( )| A. | 碱性:KOH>NaOH>Mg(OH)2>Ca(OH)2 | B. | 沸点:HF<HCl<HBr<HI | ||
| C. | 热稳定性:CH4>PH3>H2O>HF | D. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
分析 A、金属性越强,最高价氧化物对应水化物的碱性越强;
B、氢化物的相对分子量越大,沸点越高,含有氢键的物质,沸点异常高;
C、非金属性越强,氢化物越稳定;
D、非金属性越强最高价氧化物对应水化物的酸性越强.
解答 解:A、金属性越强,最高价氧化物对应水化物的碱性越强,Ca(OH)2溶解度不大,所以溶液碱性比氢氧化钠弱,所以KOH>NaOH>Ca(OH)2>Mg(OH)2,故A错误;
B、氢化物的相对分子量越大,沸点越高,含有氢键的物质,沸点异常高,所以沸点HCl<HBr<HI<HF,故B错误;
C、非金属性:P<C<O<F,所以氢化物越稳定:PH3<CH4<H2O<HF,故C错误;
D、非金属性:Cl>S>P>Si,所以酸性越强弱为:HClO4>H2SO4>H3PO4>H2SiO3,故D正确;
故选D.
点评 本题考查元素周期律的利用等,难度不大,注意规律的掌握与特殊性.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
9.下列说法正确的是( )
| A. | 根据分散系的稳定性,将分散系分为溶液、胶体和浊液 | |
| B. | 根据是否具有丁达尔效应鉴别蛋白质溶液和氯化钠溶液 | |
| C. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,生成Fe(OH)3胶体 | |
| D. | “纳米材料”是粒子直径为1 nm~100 nm的材料,纳米铜是其中的一种,它是胶体 |
10.下列实验用来证明SO2的存在,其中正确的是( )
| A. | 能使品红褪色 | |
| B. | 能使湿润的蓝色石蕊试纸变红 | |
| C. | 通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸 | |
| D. | 通入稀溴水中能使溴水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有白色沉淀,该沉淀不溶于硝酸 |
7.有机物的结构简式如图所示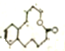 ,该有机物的分子式为( )
,该有机物的分子式为( )
 ,该有机物的分子式为( )
,该有机物的分子式为( )| A. | C14H24O2 | B. | C15H23O2 | C. | C16H24O2 | D. | C15H24O2 |
14.分子式为C11H16的单取代芳香烃,其可能的结构有( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
4.有四种溶液,它们分别含有S2-、HCO3-、Al3+、Fe2+四种离子,若向其中分别先加入足量Na2O2后,再通入过量HCl气体,溶液中离子数目基本保持不变的是( )
| A. | S2- | B. | HCO3- | C. | Al3+ | D. | Fe2+ |
11.下列晶体由原子直接构成,且属于分子晶体的是( )
| A. | 固态氢 | B. | 固态氖 | C. | 白磷 | D. | 三氧化硫 |
9.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )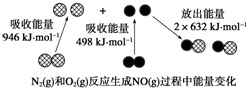

| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | N2(g)+02(g)═2NO(g)的反应热△H=+1444kJ•mol-1 | |
| D. | N2(g)和02(g)反应生成NO(g)是放热反应 |
 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题: