题目内容
【题目】下列有关反应热的叙述中正确的是
①已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热为△H=-241.8kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)![]() Z(g)+W(s) △H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
Z(g)+W(s) △H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
④已知:
共价键 | C—C | C=C | C—H | H—H |
键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
上表数据可以计算出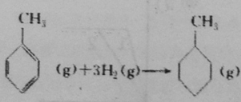 的焓变
的焓变
⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等
⑥25℃,101kPa,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
A.①②③④ B.③④⑤ C.④⑤ D.⑥
【答案】D
【解析】
试题分析:①燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,氢气燃烧生成液态水,由热化学方程式可知,氢气的燃烧热<-241.8kJmol-1,故错误;②单质A转化为单质B是一个吸热过程,则B的能量比A的高,能量越高越不稳定,故错误;③一定条件下,反应热与平衡移动无关,与化学计量数与物质的状态有关,故错误;④反应热=反应物总键能-生成物总键能,由于苯环中不存在碳碳双键,不能计算反应热,故错误;⑤金刚石与石墨的结构不同,能量不相同,在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量不相等,故错误;⑥碳的燃烧热指:25℃,101kPa时,1mol碳完全燃烧生成CO2所放出的热量,故正确,故选D。

练习册系列答案
相关题目