题目内容
【题目】一定温度下,向容积为4 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
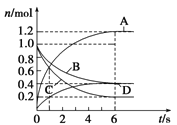
A.该反应的化学方程式为3B+4D ![]() 6A+2C
6A+2C
B.反应进行到6 s时,B的平均反应速率为0.025 mol/(L·s)
C.反应进行到6 s时,各物质的反应速率相等
D.反应进行到1 s时,v(A)=v(D)
【答案】B
【解析】
试题分析:A、由图可知,反应达到平衡时A物质增加了1.0mol、D物质增加了0.4mol、B物质减少了0.6mol、C物质了0.8mol,所以A、D为生成物,B、C为反应物,A、B、C、D物质的量之比为5:3:4:2,反应方程式为:3B+4C![]() 5A+2D,故A错误;B、反应进行到6s时,△n(B)=1mol-0.4mol=0.6mol,v(B)=
5A+2D,故A错误;B、反应进行到6s时,△n(B)=1mol-0.4mol=0.6mol,v(B)= ![]() =
=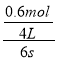 =0.25mol/(Ls),故B正确;C、根据图象可知,到6s时各物质的物质的量不再改变了,达到平衡状态,所以各物质的浓度不再变化,但是由于各物质的化学计量数不相同,则各物质的反应速率不相等,故C错误;D、反应到1s时,v(A)=
=0.25mol/(Ls),故B正确;C、根据图象可知,到6s时各物质的物质的量不再改变了,达到平衡状态,所以各物质的浓度不再变化,但是由于各物质的化学计量数不相同,则各物质的反应速率不相等,故C错误;D、反应到1s时,v(A)= ![]() =
=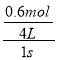 =0.15mol/(Ls),v(D)=
=0.15mol/(Ls),v(D)= ![]() =
=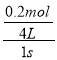 =0.05mol/(Ls),所以v(A)≠v(D),故D错误;故选B。
=0.05mol/(Ls),所以v(A)≠v(D),故D错误;故选B。

 小学课时特训系列答案
小学课时特训系列答案【题目】下列有关反应热的叙述中正确的是
①已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热为△H=-241.8kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)![]() Z(g)+W(s) △H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
Z(g)+W(s) △H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
④已知:
共价键 | C—C | C=C | C—H | H—H |
键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
上表数据可以计算出 的焓变
的焓变
⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等
⑥25℃,101kPa,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
A.①②③④ B.③④⑤ C.④⑤ D.⑥