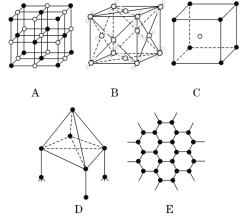
题目内容
【题目】锂离子电池是指以锂离子嵌入化合物为正极材料的电池。研究锂离子电池的电极材料、电解液具有重要的现实意义。
(1)锂离子电池的正极材料大多采用橄榄石型的LiMPO4(M=Fe、Co等元素)。
①Li+能量最低的激发态的电子排布图为______________________。
②第四电离能I4(Co)比I4(Fe)小,原因是______________________。
(2)锂离子电池的电解液有LiBF4等,碳酸亚乙酯(![]() )用作该电解液的添加剂。
)用作该电解液的添加剂。
①LiBF4中阴离子的空间构型为____________________。
②碳酸亚乙酯分子中碳原子的杂化方式为___________________;碳酸亚乙酯能溶于水的原因是______________________________________________________。
(3)硫化锂是目前正在研发的锂离子电池的新型固体电解质,为立方晶系晶体,其晶胞参数为apm。该晶胞中离子的分数坐标为:
硫离子:(0,0,0);(![]() ),
),![]() ;
;![]() ;……
;……
锂离子:![]() ;
;![]() ;
;![]() ;
;![]() ;……
;……
①在图上画出硫化锂晶胞沿x轴投影的俯视图。___________
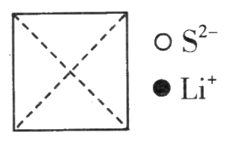
②硫离子的配位数为__________________。
③设NA为阿伏加德罗常数的值,硫化锂的晶体密度为________g·cm-3(列出计算表达式)。
【答案】![]() Co失去3d6上的一个电子,而Fe失去3d5上的一个电子,3d轨道半充满时稳定性强,故I4(Co)比I4(Fe)小 正四面体 sp3、sp2 碳酸亚乙酯分子与水分子之间形成氢键
Co失去3d6上的一个电子,而Fe失去3d5上的一个电子,3d轨道半充满时稳定性强,故I4(Co)比I4(Fe)小 正四面体 sp3、sp2 碳酸亚乙酯分子与水分子之间形成氢键  8
8 ![]()
【解析】
(1)①基态Li原子的核外电子排布图为![]() ,据此分析解答;
,据此分析解答;
②原子轨道中电子处于全满、全空或半满时较稳定,失去电子需要的能量更高;
(2)①根据VSEPR理论判断BF4-的空间构型;
②该分子中—CH2—中C原子价层电子对数是4且不含孤电子对、C=O中C原子价层电子对数是3且不含孤电子对,据此判断C原子杂化方式;碳酸亚乙酯分子与水分子之间形成氢键;
(3)①根据硫离子和锂离子的分数坐标分析判断绘图;
②从面心的S2-看,周围与之等距且最近的Li+有8个;
③根据ρ=![]() 计算晶体密度。
计算晶体密度。
(1)锂离子电池的正极材料大多采用橄榄石型的LiMPO4(M=Fe、Co等元素)。
①基态Li原子的核外电子排布图为![]() ,基态Li+的核外电子排布图为
,基态Li+的核外电子排布图为![]() ,则Li+能量最低的激发态的电子排布图为
,则Li+能量最低的激发态的电子排布图为![]() ;
;
②Co3+价电子排布为3d6变为较稳定的3d5,而Fe3+价电子排布由较稳定的3d5变为不稳定的3d4,需要更多的能量,故第四电离能:I4(Co)<I4(Fe);
(2)①对于BF4,根据VSEPR理论,B原子的孤电子对数为![]() =0,σ键电子对数为4,则其空间构型为正四面体;
=0,σ键电子对数为4,则其空间构型为正四面体;
②该分子中—CH2—中C原子价层电子对数是4且不含孤电子对,—CH2—中碳原子为sp3杂化,C=O中C原子价层电子对数是3且不含孤电子对,C=O中C原子杂化方式为sp2;碳酸亚乙酯能溶于水的原因是碳酸亚乙酯分子与水分子之间形成氢键;
(3)①根据硫离子的坐标参数,硫离子位于晶胞的面心、顶点;根据锂离子的分数坐标参数,锂离子位于晶胞的内部,结合坐标位置,则硫化锂晶胞沿x轴投影的俯视图为: ;
;
②根据①中的分析,结合俯视图,从面心的S2看,周围与之等距且最近的Li+有8个,所以S2的配位数为8;
③1个晶胞中有S2的数目为8×![]() +6×
+6×![]() =4个,含有Li+数目为8个,晶胞参数为apm,一个晶胞体积为V=a3pm3=a3×1030cm3,1mol晶胞的体积为a3×1030NAcm3,1mol晶胞质量为m=4×46g,所以晶体密度为ρ=
=4个,含有Li+数目为8个,晶胞参数为apm,一个晶胞体积为V=a3pm3=a3×1030cm3,1mol晶胞的体积为a3×1030NAcm3,1mol晶胞质量为m=4×46g,所以晶体密度为ρ=![]() =
=![]() =
=![]() g/cm3。
g/cm3。

 名校课堂系列答案
名校课堂系列答案【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000mol/L的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。 请回答下列问题:
(1)滴定前,用移液管量取待测NaOH溶液于 _____中( 填仪器名称),并加入2~3滴指示剂;
(2)盛装标准盐酸的仪器名称为 _____ ;
(3)如何判断滴定终点(需写出颜色变化) __________ ;
某学生做了三组平行实验,数据记录如下:
(4)选取下述合理数据,算出待测NaOH溶液的物质的量浓度为 ___________;(保留四位有效数字)
实验序号 | 待测NaOH溶液的体积/ mL | 0.1000mol.L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.00 | 31.00 |
3 | 25.00 | 1.00 | 27.31 |
(5)下列哪些操作会使测定结果偏低____________。
a.反应容器用蒸馏水洗净后,未用待测液润洗
b.滴定前,平视读数;滴定后,仰视读数
c.滴定前,尖嘴无气泡;滴定后,尖嘴出现气泡