题目内容
【题目】常温下,分别取未知浓度的AOH和BOH两种碱的稀溶液,加水稀释至原体积的n倍。两溶液稀释倍数的对数值(lgn)与溶液的pH变化关系如图所示。下列叙述正确的是
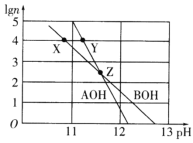
A.水的电离程度:Z>X=Y
B.常温下,Kb(BOH)<Kb(AOH)
C.中和等体积X、Y两点溶液,后者消耗HC1的物质的量多
D.物质的量浓度相同的AC1溶液和BC1溶液,前者阳离子浓度之和小于后者
【答案】CD
【解析】
A.碱溶液中H+全部来自水的电离,碱溶液的pH越大,水的电离程度越小,根据图像pH:Z>Y>X,则水的电离程度:Z<Y<X,故A错误;
B.根据图像,稀释相同倍数时BOH溶液pH的改变值大于AOH溶液pH的改变值,说明BOH的碱性大于AOH,则常温下电离平衡常数:Kb(BOH)>Kb(AOH),故B错误;
C.根据图像,稀释相同倍数时BOH溶液pH的改变值大于AOH溶液pH的改变值,说明BOH的碱性大于AOH,X、Y两点溶液稀释的倍数相同,Y点的pH大于X点,故Y点对应的AOH物质的量浓度较大,中和等体积X、Y两点溶液,Y消耗HC1的物质的量较多,故C正确;
D.根据图像,稀释相同倍数时BOH溶液pH的改变值大于AOH溶液pH的改变值,说明BOH的碱性大于AOH,物质的量浓度相同的AC1和BC1,氯离子浓度相等,由于A+的水解程度大于B+,则ACl溶液中c(H+)大于BCl溶液中c(H+),ACl溶液中c(OH-)小于BCl溶液中c(OH-),结合AC1和BC1溶液中存在的电荷守恒:c(A+)+c(H+)=c(OH)+c(C1),c(B+)+c(H+)=c(OH)+c(C1),ACl溶液中阳离子浓度之和小于BCl溶液中阳离子浓度之和,故D正确;
答案选CD。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目