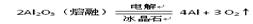题目内容
回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图。
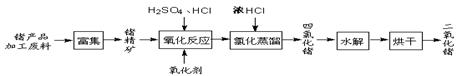
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式 。
(2)蒸馏可获GeCl4,在此过程中加入浓盐酸的原因是 。
(3)GeCl4水解生成GeO2·nH2O,化学方程式为 。温度对GeCl4的水解率产生的影响如图1所示,其原因是该水解反应ΔH 0(“>”或“<”)。为控制最佳的反应温度,实验时可采取的措施为 水浴。

A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)已知Ge的单质和化合物性质与Al的相似,试用离子方程式表示在pH>8的溶液中GeO2逐渐溶解时发生的反应 。

(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式 。
(2)蒸馏可获GeCl4,在此过程中加入浓盐酸的原因是 。
(3)GeCl4水解生成GeO2·nH2O,化学方程式为 。温度对GeCl4的水解率产生的影响如图1所示,其原因是该水解反应ΔH 0(“>”或“<”)。为控制最佳的反应温度,实验时可采取的措施为 水浴。

A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)已知Ge的单质和化合物性质与Al的相似,试用离子方程式表示在pH>8的溶液中GeO2逐渐溶解时发生的反应 。
(15分)
(1)Ge2++H2O2+2H+=Ge4++2H2O (3分) (2)抑制GeCl4水解 (2分)
(3)GeCl4+ (2+n) H2O = GeO2·nH2O+ 4HCl (3分) < (2分) C (2分)
(4) GeO2+2OH-=GeO32—+H2O (3分)
(1)Ge2++H2O2+2H+=Ge4++2H2O (3分) (2)抑制GeCl4水解 (2分)
(3)GeCl4+ (2+n) H2O = GeO2·nH2O+ 4HCl (3分) < (2分) C (2分)
(4) GeO2+2OH-=GeO32—+H2O (3分)
试题分析:(1)锗元素由+2升为+4价,说明Ge2+是还原剂,过氧化氢是氧化剂,所含氧元素由—1降为—2,根据最小公倍数法配平,则该反应为Ge2++H2O2+2H+=Ge4++2H2O;(4)锗位于金属元素与非金属元素交界位置,因此推断它与铝相似,则GeCl4是强酸弱碱盐,蒸馏时加入盐酸能抑制它水解,防止转变为GeO2;(3)根据盐类水解原理,1mol GeCl4与4molH2O完全水解生成1molGe(OH)4和4molHCl,1molGe(OH)4受热分解生成1mol GeO2和2molH2O,由此可得GeCl4+ (2+n) H2O = GeO2·nH2O+ 4HCl;读图,相同时间内,随着反应温度的升高,水解率减小,前者使平衡向吸热反应方向移动,后者说明平衡向逆反应方向,则逆反应是吸热反应,由于正、逆反应的反应热恰好相反,则正反应是放热反应,因此该水解反应的焓变小于0;根据实验目的,为了制取更快、更多地制备GeO2·nH2O,应选择的温度为—12℃,由于冰水混合物的温度为0℃,盐可以降低水的凝固点,则冰盐水的温度低于0℃,因此只有C项正确;(4)根据相似类推,Al2O3与强碱溶液反应的原理为Al2O3+2OH—=2AlO2—+H2O,由此推断在碱性溶液反应生成锗酸盐和水,即 GeO2+2OH-=GeO32—+H2O。

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
 3Mn + 2Al2O3
3Mn + 2Al2O3 2Al + 3Cl2
2Al + 3Cl2 2Hg+ O2↑
2Hg+ O2↑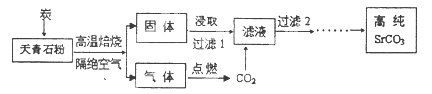
 SrSO4(s)+CO
SrSO4(s)+CO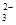 (aq) SrCO3(s)+SO
(aq) SrCO3(s)+SO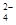 (aq)
(aq)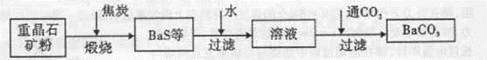
 BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)
 2Hg + O2 ↑
2Hg + O2 ↑