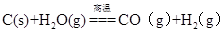题目内容
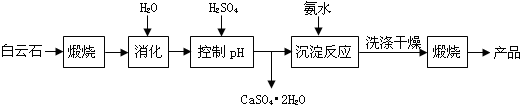
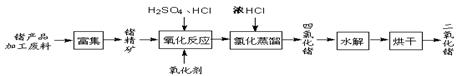
工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温锻烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单的表示如下:
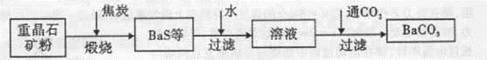
(1)若“煅烧”时产生一种有毒的还原性气体,则反应的化学方程式为______。
(2)工业上煅烧重晶石矿粉时,为使BaSO4得到充分的还原和维持及应所需的高温,应采取的措施是______。
a.加人过量的炭,同时通入空气 b.设法将生成的BaS及时移出
(3)在第一次过滤后洗涤,检验是否洗涤干净的试剂最好是______。
(4)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4 (s)+CO32-(aq) BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)
则:①在实验室将少量BaSO4固体全部转化为BaCO3的实验操作方法与步骤为______。
②与高温煅烧还原法相比,沉淀转化法的优点主要有______。
③已知:Ksp(BaCO3)=2.40×10-9,Ksp(BaSO4)=1.20×10-10。现欲用沉淀转化法将BaSO4转化为BaCO3,该反应的平衡常数为______。如用1.00 L 0. 210 mol ? L-1 Na2CO3溶液处理,试计算BaSO4被转化的质量______(要有计算过程,结果保留3位有效数字)。

(1)若“煅烧”时产生一种有毒的还原性气体,则反应的化学方程式为______。
(2)工业上煅烧重晶石矿粉时,为使BaSO4得到充分的还原和维持及应所需的高温,应采取的措施是______。
a.加人过量的炭,同时通入空气 b.设法将生成的BaS及时移出
(3)在第一次过滤后洗涤,检验是否洗涤干净的试剂最好是______。
(4)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4 (s)+CO32-(aq)
 BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)则:①在实验室将少量BaSO4固体全部转化为BaCO3的实验操作方法与步骤为______。
②与高温煅烧还原法相比,沉淀转化法的优点主要有______。
③已知:Ksp(BaCO3)=2.40×10-9,Ksp(BaSO4)=1.20×10-10。现欲用沉淀转化法将BaSO4转化为BaCO3,该反应的平衡常数为______。如用1.00 L 0. 210 mol ? L-1 Na2CO3溶液处理,试计算BaSO4被转化的质量______(要有计算过程,结果保留3位有效数字)。
(18分)
(1)BaSO4+4C BaS+4CO↑(3分)
BaS+4CO↑(3分)
(2)a(2分)
(3)H2SO4(2分,其它合理答案也给分)
(4)①将适量饱和Na2CO3溶液加入BaSO4固体中,充分搅拌,静置、弃去上层清液;如此操作,反复多次(直到BaSO4全部转化为BaCO3)(3分)
②节能、环保等(2分)
③5×10-2(2分)
解:设BaSO4被转化的物质的量为xmol,则碳酸根离子的变化浓度为xmol/L,即:
BaSO4 (s)+CO32-(aq) BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)
起始浓度/mol?L-1 0.210 0
变化浓度/mol?L-1 x x
起始浓度/mol?L-1 0.210—x x (1分)
由于K=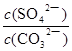 =
=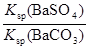 ,则
,则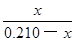 =
=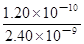 (1分)
(1分)
解得:x=0.0100(1分)
由于m=n?M,则BaSO4被转化的质量为0.0100mol×233g/mol=2.33g(1分)
答:BaSO4被转化的质量为2.33g。
(1)BaSO4+4C
 BaS+4CO↑(3分)
BaS+4CO↑(3分)(2)a(2分)
(3)H2SO4(2分,其它合理答案也给分)
(4)①将适量饱和Na2CO3溶液加入BaSO4固体中,充分搅拌,静置、弃去上层清液;如此操作,反复多次(直到BaSO4全部转化为BaCO3)(3分)
②节能、环保等(2分)
③5×10-2(2分)
解:设BaSO4被转化的物质的量为xmol,则碳酸根离子的变化浓度为xmol/L,即:
BaSO4 (s)+CO32-(aq)
 BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)起始浓度/mol?L-1 0.210 0
变化浓度/mol?L-1 x x
起始浓度/mol?L-1 0.210—x x (1分)
由于K=
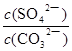 =
=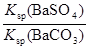 ,则
,则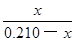 =
=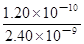 (1分)
(1分)解得:x=0.0100(1分)
由于m=n?M,则BaSO4被转化的质量为0.0100mol×233g/mol=2.33g(1分)
答:BaSO4被转化的质量为2.33g。
试题分析:(1)依题意,BaSO4与C在高温下发生氧化还原反应,生成BaS和CO,硫元素由+6降为—2价,碳元素由0升为+2价,根据化合价升降总数相等、原子个数守恒,则该反应为BaSO4+4C
 BaS+4CO↑;(2)加入过量的碳,同时通入空气,可以使C与氧气反应,该反应是放热反应,碳过量不仅能使硫酸钡充分还原,还能维持反应所需的高温,故a正确;硫化钡是固体,固体物质的浓度是常数,将生成的硫化钡及时移走,不能使平衡向正反应方向移动,故b错误;(3)硫化钡是强碱弱酸盐,能溶于水,且与水反应生成氢氧化钡和硫化氢气体,氢氧化钡是可溶性强碱,过量的碳或未完全反应的硫酸钡等难溶于水,过滤所得滤渣的主要成分是碳或硫酸钡等物质,滤渣能吸附可溶性的钡离子、氢氧根离子,钡离子遇硫酸产生白色的硫酸钡沉淀,因此取最后一次洗涤液少许于试管,滴入少量稀硫酸,若产生白色沉淀,说明沉淀未洗涤干净;反之,则洗涤干净;另外,选择酚酞等指示剂也可以检验是否含有氢氧根离子;(4)根据浓度对平衡移动的影响规律,增大碳酸根离子浓度,可以使沉淀平衡右移,则设计的实验方案为①将适量饱和Na2CO3溶液加入BaSO4固体中,充分搅拌,静置、弃去上层清液;如此操作,反复多次(直到BaSO4全部转化为BaCO3);②高温煅烧法需要消耗能量,产生有毒的硫化氢气体,步骤多,而沉淀转化法则节约能源,环保,操作步骤少等;③设BaSO4被转化的物质的量为xmol,则碳酸根离子的变化浓度为xmol/L,即:
BaS+4CO↑;(2)加入过量的碳,同时通入空气,可以使C与氧气反应,该反应是放热反应,碳过量不仅能使硫酸钡充分还原,还能维持反应所需的高温,故a正确;硫化钡是固体,固体物质的浓度是常数,将生成的硫化钡及时移走,不能使平衡向正反应方向移动,故b错误;(3)硫化钡是强碱弱酸盐,能溶于水,且与水反应生成氢氧化钡和硫化氢气体,氢氧化钡是可溶性强碱,过量的碳或未完全反应的硫酸钡等难溶于水,过滤所得滤渣的主要成分是碳或硫酸钡等物质,滤渣能吸附可溶性的钡离子、氢氧根离子,钡离子遇硫酸产生白色的硫酸钡沉淀,因此取最后一次洗涤液少许于试管,滴入少量稀硫酸,若产生白色沉淀,说明沉淀未洗涤干净;反之,则洗涤干净;另外,选择酚酞等指示剂也可以检验是否含有氢氧根离子;(4)根据浓度对平衡移动的影响规律,增大碳酸根离子浓度,可以使沉淀平衡右移,则设计的实验方案为①将适量饱和Na2CO3溶液加入BaSO4固体中,充分搅拌,静置、弃去上层清液;如此操作,反复多次(直到BaSO4全部转化为BaCO3);②高温煅烧法需要消耗能量,产生有毒的硫化氢气体,步骤多,而沉淀转化法则节约能源,环保,操作步骤少等;③设BaSO4被转化的物质的量为xmol,则碳酸根离子的变化浓度为xmol/L,即:BaSO4 (s)+CO32-(aq)
 BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)起始浓度/mol?L-1 0.210 0
变化浓度/mol?L-1 x x
起始浓度/mol?L-1 0.210—x x (1分)
由于K=
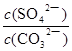 =
=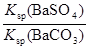 =
=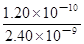 =5×10-2
=5×10-2则
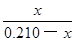 =
=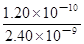 =5×10-2(1分)
=5×10-2(1分)解得:x=0.0100(1分)
由于m=n?M,则BaSO4被转化的质量为0.0100mol×233g/mol=2.33g(1分)。

练习册系列答案
相关题目