题目内容
【题目】尿素/H2O2溶液可用于烟气的脱硫脱硝。
(1)已知T℃时,2SO2(g)+O2(g) ![]() 2SO3(g) △H1
2SO3(g) △H1
2H2O2(I)=2H2O(I)+O2(g) △H2
SO3(g)+H2O(I))=H2SO4(I) △H3
则SO2(g)+H2O2(I))=H2SO4(I) △H4=__________ (用含△H1、△H2、△H3的代数式表示)
(2)尿素[CO(NH2)2]溶液对NOx及SO2有一定的脱除率。将SO2和NOx (N〇约占90%)通入氧气的体积分数为7%、尿素浓度为5%的反应器中进行反应。
①烟气中SO2最终转化为一种正盐,其化学式为______________;NO和NO2以物质的量之比1:1与
CO(NH2)2反应生成无毒气体的化学方程式为_________________________。
②氨基甲酸铵(H2NCOONH4)是尿素的水解产物,将一定量的氨基甲酸铵置于恒容密闭容器中,发生反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
温度/K | 338 | 343 | 348 | 353 |
平衡时气体的总浓度/mol L-1 | 0.36 | 0.48 | 0.60 | 0.72 |
该反应的△H__________(填“>”或“<”)0;348K时,该反应的平衡常数K__________________。
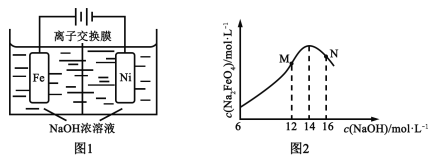
(3)其他条件不变,向尿素溶液中添加H2O2溶液,测得不同 pH下氮氧化物的脱除率与时间的关系如图
所示。
①NO与H2O2发生反应生成亚硝酸时,氧化剂与还原剂的物质的量之比为____________。
②脱硝时,最佳pH为_________;在碱性较强时,NOx脱除率降低,其原因是_____________________
(任写一点)。
【答案】(1) ![]() ΔH1+
ΔH1+![]() ΔH2+ΔH3 (2) ①(NH4)2SO4 NO+NO2+CO(NH2)2=2N2+CO2+2H2O
ΔH2+ΔH3 (2) ①(NH4)2SO4 NO+NO2+CO(NH2)2=2N2+CO2+2H2O
② > 0.032 (3) ① 1:2 ② 7 H2O2氧化性减弱(或其他合理答案)
【解析】(1). 反应SO2(g)+H2O2(I))=H2SO4(I)可由①2SO2(g)+O2(g) ![]() 2SO3(g)②2H2O2(I)=2H2O(I)+O2(g)③SO3(g)+H2O(I))=H2SO4(I)经如下处理①
2SO3(g)②2H2O2(I)=2H2O(I)+O2(g)③SO3(g)+H2O(I))=H2SO4(I)经如下处理①![]() +②
+②![]() +③得到,所以 △H4=
+③得到,所以 △H4= ![]() ΔH1+
ΔH1+![]() ΔH2+ΔH3
ΔH2+ΔH3
(2). ①烟气中SO2通入氧气的体积分数为7%、尿素浓度为5%的反应器中,二氧化硫可以被氧气氧化为硫酸,硫酸可以催化尿素(分子中含酰胺键)发生水解,并与尿素的水解产物氨反应生成硫酸铵,所以最终转化的正盐化学式为(NH4)2SO4 ;NO和NO2以物质的量之比1:1与CO(NH2)2反应生成无毒气体,根据NO中N元素的化合价为+2,NO2中N元素的化合价为+4,而中N元素化合价为-3、C元素的化合价为+4,三种价态的N元素发生归中反应右生成氮气,+4价的C可以转化为CO2,所以此无毒气体是氮气和二氧化碳,化学方程式为NO+NO2+CO(NH2)2=2N2+CO2+2H2O。②将一定量的氨基甲酸铵置于恒容密闭容器中发生反应,根据表中数据可知,平衡时气体的总浓度随温度的升高而增大,所以升高温度后,化学平衡向正反应反应方向移动,因此,正反应为吸热反应,△H>0。348K时,平衡气体的总浓度为0.60/mol L-1, 由NH2COONH4(s)![]() 2NH3(g)+CO2(g)可求出c(NH3)=0.40 mol L-1、c(CO2)=0.20 mol L-1, 代入该反应的平衡常数表达式K= c2(NH3)
2NH3(g)+CO2(g)可求出c(NH3)=0.40 mol L-1、c(CO2)=0.20 mol L-1, 代入该反应的平衡常数表达式K= c2(NH3) ![]() c(CO2)= 0.032。
c(CO2)= 0.032。
(3). ①NO与H2O2发生反应生成亚硝酸时,双氧水是氧化剂,一氧化氮是还原剂,化学方程式为2NO+H2O2=2HNO2,所以氧化剂与还原剂的物质的量之比为1:2。
(2)由图中信息可知:pH=7时,氮氧化物脱除率最高,所以脱硝时,最佳pH为7;在碱性较强时,NOx脱除率降低,其原因是H2O2氧化性随溶液碱性增强而减弱。

【题目】雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如下
分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
化学键 | N≡O | C≡O | C=O | N≡N |
键能(KJ/mol) | 632 | 1072 | 750 | 946 |
请完成汽车尾气净化中NO(g)和CO(g)发生反应的热化学方程式
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=_________kJ/mol
N2(g)+2CO2(g) ΔH=_________kJ/mol
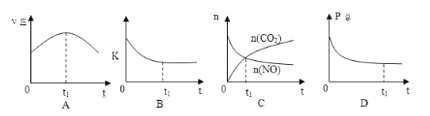
②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是_________(填选项序号)。(下图中v正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)
(2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO , 测得了不同时间时NO和CO的物质的量如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/×l0-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
n(CO)/×l0-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
t1℃时该反应的平衡常数K=__,既能增大反应速率又能使平衡正向移动的措施是_。(写出一种即可)
(3)如图1所示,以N2O4为原料采用电解法可制备新型绿色硝化剂(一种氮氧化物)写出生成这种硝化剂的阳极电极反应式________________________。


图1 图2
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/c(NO)、不同温度对脱氮率的影响如图2所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响_______________,给出合理的解释:____________________。
【题目】煤的气化主要反应是煤中碳与水蒸气反应生成CO、H2等。回答下列问题:
(1)CO与H2分别与O2都可以设计成燃料电池。CO与O2设计成燃料电池(以熔融碳酸盐为电解质)负极的电极反应为:______________;
(2)在煤的气化获得的化工原料气中含有少量羰基硫(COS),能引起催化剂中毒、大气污染等。COS的电子式为___________;羰基硫与烧碱溶液反应生成水喝两种正盐的离子方程式为:__________;羰基硫的脱硫常用两种方法,其反应式分别为:
①氢解反应:COS(g) + H2(g) = H2S(g) + CO(g) ΔH1 =+7kJ/mol
②水解反应:COS(g) + H2O(g) = H2S(g) + CO2(g) ΔH2
已知反应中相关的化学键键能数据如下:
化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
则ΔH2 =____________kJ/mol。
(3)脱硫处理后的CO和H2在催化剂作用下合成甲醇:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2 =-90.14kJ/mol。该反应能自发的理由是_______
CH3OH(g)+H2O(g) ΔH2 =-90.14kJ/mol。该反应能自发的理由是_______
①一定温度下,在两个容积都为为VL的恒容莫比容器中,按如下方式加入反应物,一段时间后达到平衡:
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、3a molH2、 n molCH3OH(g)、n molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则n的取值范围为_____________;
②甲容器保持恒容,欲增大H2的平衡转化率,可采取的措施有:________(答两点即可)