题目内容
【题目】根据所学内容填空:
Ⅰ.化学反应 2A+B2C;△H<0达到化学平衡时,根据以下条件改变填空:
(1)若A、B、C都是气体,且C为有色气体.
①使密闭容器体积增大,A的转化率_______;(填增大、减小、不变)
②如果升高温度,平衡混合物的颜色______;(填加深、变浅、不变)
(2)若A、C为气体,B为固体;
①加压,则A的体积分数________;(填增大、减小、不变)
②增加B的量,A的转化率_______.(填增大、减小、不变)
Ⅱ.(1)H2S溶于水的电离方程式为________________________。向H2S溶液中加入NaOH固体时,c(H+)_________,c(S2-)__________。(填增大、减小或不变)
(2) 下列物质能导电且属于电解质的是________(填序号)。
A.铁 B.盐酸 C.氯化钠晶体 D.熔融氢氧化钠
(3)23g C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出683.4 kJ热量,写出该反应的热化学方程式_________________。
【答案】减小变浅不变不变略减小增大DC2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ/mol
【解析】Ⅰ.化学反应 2A+B![]() 2C;△H<0达到化学平衡时
2C;△H<0达到化学平衡时
(1)若A、B、C都是气体,且C为有色气体;
①使密闭容器体积增大,压强减小,平衡逆向进行,A的转化率减小;
②反应是放热反应,如果升高温度,平衡逆向进行,C为有色气体,平衡混合物的颜色变浅;
(2)若A、C为气体,B为固体;
①反应前后气体体积不变,加压平衡不动,则A的体积分数不变;
②B为固体,增加B的量,不允许化学平衡,平衡不动,A的转化率不变;
Ⅱ.(1)H2S是二元弱酸,溶于水分步电离,其在水中的电离方程式为H2S![]() H++HS-、HS-
H++HS-、HS-![]() H++S2-;向H2S溶液中加入NaOH固体时,因与电离的H+发生中和反应,促进H2S的电离,c(H+)减小,c(S2-)增大;
H++S2-;向H2S溶液中加入NaOH固体时,因与电离的H+发生中和反应,促进H2S的电离,c(H+)减小,c(S2-)增大;
(2)A.铁是单质,不是电解质,故A错误;B.盐酸是混合物,不是电解质,故B错误;C.氯化钠在水溶液里或熔融状态下能导电的化合物,是电解质,但是不含有自由移动的离子或自由电子,不导电,故C错误;D.熔融氢氧化钠含有自由移动的离子能够导电,是电解质,故D选;故选D。
(3)23g C2H5OH(l)的物质的量为0.5mol,1mol乙醇完全燃烧放出的热量为1366.8kJ,则乙醇完全燃烧生成CO2(g)和H2O(l)的热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ/mol。

【题目】尿素/H2O2溶液可用于烟气的脱硫脱硝。
(1)已知T℃时,2SO2(g)+O2(g) ![]() 2SO3(g) △H1
2SO3(g) △H1
2H2O2(I)=2H2O(I)+O2(g) △H2
SO3(g)+H2O(I))=H2SO4(I) △H3
则SO2(g)+H2O2(I))=H2SO4(I) △H4=__________ (用含△H1、△H2、△H3的代数式表示)
(2)尿素[CO(NH2)2]溶液对NOx及SO2有一定的脱除率。将SO2和NOx (N〇约占90%)通入氧气的体积分数为7%、尿素浓度为5%的反应器中进行反应。
①烟气中SO2最终转化为一种正盐,其化学式为______________;NO和NO2以物质的量之比1:1与
CO(NH2)2反应生成无毒气体的化学方程式为_________________________。
②氨基甲酸铵(H2NCOONH4)是尿素的水解产物,将一定量的氨基甲酸铵置于恒容密闭容器中,发生反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
温度/K | 338 | 343 | 348 | 353 |
平衡时气体的总浓度/mol L-1 | 0.36 | 0.48 | 0.60 | 0.72 |
该反应的△H__________(填“>”或“<”)0;348K时,该反应的平衡常数K__________________。
(3)其他条件不变,向尿素溶液中添加H2O2溶液,测得不同 pH下氮氧化物的脱除率与时间的关系如图
所示。
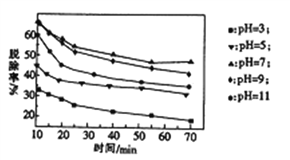
①NO与H2O2发生反应生成亚硝酸时,氧化剂与还原剂的物质的量之比为____________。
②脱硝时,最佳pH为_________;在碱性较强时,NOx脱除率降低,其原因是_____________________
(任写一点)。


