题目内容
【题目】雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如下
分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
化学键 | N≡O | C≡O | C=O | N≡N |
键能(KJ/mol) | 632 | 1072 | 750 | 946 |
请完成汽车尾气净化中NO(g)和CO(g)发生反应的热化学方程式
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=_________kJ/mol
N2(g)+2CO2(g) ΔH=_________kJ/mol
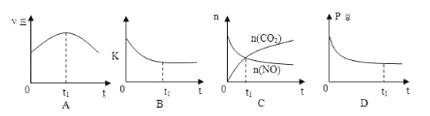
②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是_________(填选项序号)。(下图中v正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)
(2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO , 测得了不同时间时NO和CO的物质的量如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/×l0-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
n(CO)/×l0-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
t1℃时该反应的平衡常数K=__,既能增大反应速率又能使平衡正向移动的措施是_。(写出一种即可)
(3)如图1所示,以N2O4为原料采用电解法可制备新型绿色硝化剂(一种氮氧化物)写出生成这种硝化剂的阳极电极反应式________________________。
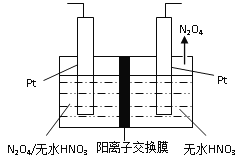
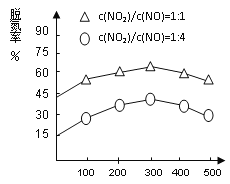
图1 图2
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/c(NO)、不同温度对脱氮率的影响如图2所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响_______________,给出合理的解释:____________________。
【答案】(1)① -538 ②A,B,C (2)500 加压等。 (3) N2O4+2HNO3-2e-=2N2O5+2H+ (4)300℃之前,温度升高脱氮率逐渐增大 300℃之后,温度升高脱氮率逐渐减小
300℃之前,反应未平衡,反应向右进行,脱氮率增大 300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小
【解析】(1)①本题考查焓变与键能的关系,△H=反应物键能总和-生成物键能总和=[2×632+2×1072-(946+4×750)]kJ·mol-1=-538kJ·mol-1;②本题考查化学平衡状态的判断,A、因为是恒温恒容,因此正反应速率随着反应进行而减小,故说法错误;B、化学平衡常数只受温度的影响,温度不变,化学平衡常熟不变,因为是恒温状态,因此化学平衡状态不变,故说法错误;C、根据图像,t1时刻没有达到平衡,故说法错误;D、压强与物质的量成正比,反应前气体物质的量大于反应后气体物质的量,因此随着反应进行,压强减少,故说法正确;(2)本题考查化学平衡常数的计算以及影响化学反应速率和平衡移动因素,
2NO(g)+2CO(g)![]() N2(g) + 2CO2(g)
N2(g) + 2CO2(g)
起始:(mol·L-1) 1×10-2 3.6×10-2 0 0
变化: 9×10-3 9×10-2 4.5×10-3 9×10-3
平衡: 1×10-3 2.7×10-2 4.5×10-3 9×10-3,根据平衡常数定义,K=c2(CO2)×c(N2)/[c2(NO)×c2(CO)],代入数值,解得K=500,增大反应速率以及反应向正反应方向移动,采取措施是加压,增加NO或CO的浓度等;(3)本题考查电极反应式的书写,阳极是失电子,化合价升高,根据工作原理,阳极应是左端的Pt,N2O4-2e-→N2O5,加入无水HNO3,因此电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+;(4)根据图像得出:300℃之前,反应未平衡,反应向右进行,脱氮率增大;300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小。

 口算题天天练系列答案
口算题天天练系列答案【题目】尿素/H2O2溶液可用于烟气的脱硫脱硝。
(1)已知T℃时,2SO2(g)+O2(g) ![]() 2SO3(g) △H1
2SO3(g) △H1
2H2O2(I)=2H2O(I)+O2(g) △H2
SO3(g)+H2O(I))=H2SO4(I) △H3
则SO2(g)+H2O2(I))=H2SO4(I) △H4=__________ (用含△H1、△H2、△H3的代数式表示)
(2)尿素[CO(NH2)2]溶液对NOx及SO2有一定的脱除率。将SO2和NOx (N〇约占90%)通入氧气的体积分数为7%、尿素浓度为5%的反应器中进行反应。
①烟气中SO2最终转化为一种正盐,其化学式为______________;NO和NO2以物质的量之比1:1与
CO(NH2)2反应生成无毒气体的化学方程式为_________________________。
②氨基甲酸铵(H2NCOONH4)是尿素的水解产物,将一定量的氨基甲酸铵置于恒容密闭容器中,发生反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
2NH3(g)+CO2(g) △H,实验测得不同温度下平衡时气体的总浓度如下表:
温度/K | 338 | 343 | 348 | 353 |
平衡时气体的总浓度/mol L-1 | 0.36 | 0.48 | 0.60 | 0.72 |
该反应的△H__________(填“>”或“<”)0;348K时,该反应的平衡常数K__________________。
(3)其他条件不变,向尿素溶液中添加H2O2溶液,测得不同 pH下氮氧化物的脱除率与时间的关系如图
所示。
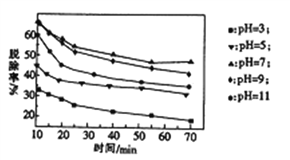
①NO与H2O2发生反应生成亚硝酸时,氧化剂与还原剂的物质的量之比为____________。
②脱硝时,最佳pH为_________;在碱性较强时,NOx脱除率降低,其原因是_____________________
(任写一点)。