题目内容
11.mg的铜投入l00ml某浓度HNO3中,铜完全溶解,共收集到672ml NO、NO2混合气体(标准状况).向反应后的溶液中滴入100m1 8mol/L NaOH溶液时沉淀达到最大;将盛有反应生成气体的容器倒扣在水中,通入标准状况下的O2 448ml,恰好使气体完全溶于水中.则下列有关说法正确的是( )| A. | m的值为2.56 | |
| B. | 反应之前硝酸溶液的浓度为8 mol/L | |
| C. | NO与NO2混合气中NO与NO2的体积之比为l:5 | |
| D. | 沉淀的最大质量为(m+0.8x17)g |
分析 m g的铜投入某浓度HNO3中,铜完全溶解,共收集到NO、NO2混合气体(标准状况).将盛有此气体的容器倒扣在水中,通入标准状况下的O2448ml,恰好使气体完全溶于水中,反应又得到硝酸,纵观整个过程Cu提供的电子等于氧气获得的电子.向反应后的溶液中滴入NaOH溶液时沉淀达到最大,此时溶液中溶质为NaNO3,由电荷守恒可知,铜提供电子物质的量等于沉淀中氢氧根离子物质的量.
A.根据电子转移守恒计算n(Cu),再根据m=nM计算Cu的质量;
B.向反应后的溶液中滴入NaOH溶液时沉淀达到最大,此时溶液中溶质为NaNO3,根据钠离子守恒n(NaNO3)=n(NaOH),根据氮元素守恒n(HNO3)=n(NaNO3)+n(NO、NO2);
C.根据电子转移守恒、二者总体积列方程计算各自物质的量,相同体积气体体积之比等于其物质的量之比;
D.沉淀质量等于Cu的质量与氢氧根离子质量之和.
解答 解:m g的铜投入某浓度HNO3中,铜完全溶解,共收集到NO、NO2混合气体(标准状况).将盛有此气体的容器倒扣在水中,通入标准状况下的O2448ml,恰好使气体完全溶于水中,反应又得到硝酸,纵观整个过程Cu提供的电子等于氧气获得的电子,氧气物质的量为$\frac{0.448L}{22.4L/mol}$=0.02mol,故Cu提供电子为0.02mol×4=0.08mol,向反应后的溶液中滴入NaOH溶液时沉淀达到最大,此时溶液中溶质为NaNO3,由电荷守恒可知,铜提供电子物质的量等于沉淀中氢氧根离子物质的量,即沉淀中氢氧根离子为0.08mol.
A.根据电子转移守恒n(Cu)=$\frac{0.08mol}{2}$=0.04mol,则Cu的质量为0.04mol×64g/mol=2.56g,故A正确;
B.向反应后的溶液中滴入NaOH溶液时沉淀达到最大,此时溶液中溶质为NaNO3,根据钠离子守恒n(NaNO3)=n(NaOH)=0.1L×8mol/L=0.8mol,NO、NO2混合气体总物质的量为$\frac{0.672L}{22.4L/mol}$=0.03mol,根据氮元素守恒n(HNO3)=n(NaNO3)+n(NO、NO2)=0.8mol+0.03mol=0.83mol,故反应之前硝酸溶液的浓度为$\frac{0.83mol}{0.1L}$=8.3mol/L,故B错误;
C.设NO、NO2的物质的量分别为xmol、ymol,则:$\left\{\begin{array}{l}{x+y=0.03}\\{3x+y=0.08}\end{array}\right.$,解得x=0.025,y=0.005,故NO与NO2的体积之比为5:1,故C错误;
D.沉淀质量等于Cu的质量与氢氧根离子质量之和,即沉淀质量为(m+0.08×17)g,故D错误,
故选A.
点评 本题考查氧化还原反应计算、混合物计算等,注意电子转移守恒与原子守恒应用,侧重考查学生分析计算能力,难度中等.

| A. | 该化合物中C、H原子数之比为1:2 | |
| B. | 无法确定其分子式 | |
| C. | 分子式可以确定,但官能团类别无法确定 | |
| D. | 该化合物属于烃的衍生物 |
| A. | 液氨是纯净物,而氯水是电解质,漂白粉是混合物 | |
| B. | 氯气可用作消毒剂和漂白剂,是因为氯气分子具有强氧化性 | |
| C. | 随着化合价的升高,氯的含氧酸的酸性逐渐增强 | |
| D. | 双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境没有污染 |
| A. | 煤的气化、液化和干馏都属于化学变化 | |
| B. | 石油的裂化可以提高轻质油的产量和质量 | |
| C. | 石油分馏可获得乙烯、丙烯 | |
| D. | 苯等有机物是从煤干馏产物中分离出来的 |
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| 分子式 | C6H806 |
| 物理特性 | 可口酸味 |
| 化学特性 | 还原性,易被氧化 |
| 重要功能 | 抗坏血病 |
| 主要存在 | 新鲜水果,绿色蔬菜 |
(2)维生素C是一种水溶性维生素,其水溶液显酸性(填“酸”或“碱”),服用补铁(Fe2+)制剂时医生常建议同时服用维生素C,这是因为维生素C具有还原(填“氧化”或“还原”)性;生吃新鲜蔬菜要比熟吃时维生素C的损失小,因为维生素C在受热时很容易被氧化 (填“氧化”或“还原”);
(3)维生素C对于治疗下列哪种疾病比较有效A.
A.坏血病 B.脑炎 C.骨折 D.肺炎.
| A. | H2和D2互为同位素 | B. | 正丁烷和异丁烷互为同系物 | ||
| C. | 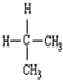 与 与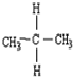 互为同分异构体 互为同分异构体 | D. | 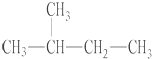 和 和 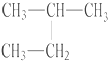 是同一种物质 是同一种物质 |
| A. | 盐酸 | B. | 酸性高锰酸钾溶液 | ||
| C. | NaOH溶液 | D. | CCl4 |
| A. | NH4NO3 | B. | CaF2 | C. | Na2S2 | D. | Na3N |