题目内容
(8分)氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为KOH,负极反应为_________________________________________
(2)若电解质溶液为硫酸,其正极反应为______________________ ,若在常温下转移2mol电子,可产生水质量为_________g。
(3)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到1.12L (标准状况)气体。此时氢氧燃料电池中消耗H2和O2的物质的量各是多少?(写出计算过程)(保留2位小数)
(1)若电解质溶液为KOH,负极反应为_________________________________________
(2)若电解质溶液为硫酸,其正极反应为______________________ ,若在常温下转移2mol电子,可产生水质量为_________g。
(3)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)=3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到1.12L (标准状况)气体。此时氢氧燃料电池中消耗H2和O2的物质的量各是多少?(写出计算过程)(保留2位小数)
(1) 2 H2-4 e- + 4 OH-=4 H2O (2) O2+4e-+ 4 H+ = 2 H2O 18 g
(3)H2和O2的物质的量分别为:0. 15 mol, 0.075 mol
(3)H2和O2的物质的量分别为:0. 15 mol, 0.075 mol
(1)负极失去电子,所以电极反应式为2 H2-4 e- + 4 OH-=4 H2O。
(2)正极得到电子,所以氧气在正极通入,电极反应式为O2+4e-+ 4 H+ = 2 H2O。每生成1mol水就转移2mol电子,所以是的质量是18g。
(3)考查电解池的有关计算。
阴极生成气体,说明铜离子全部析出,所以反应中转移电子是1mol/L×0.1L×2+1.12L÷22.4L/mol×2=0.3mol。
设消耗H2和O2的物质的量分别为x、y,则根据电子得失守恒可知
2H2 + O2 2H2O 4e—
2mol 1mol 4mol
x y 0.3mol
解得:x="0." 15 mol y="0.075" mol
(2)正极得到电子,所以氧气在正极通入,电极反应式为O2+4e-+ 4 H+ = 2 H2O。每生成1mol水就转移2mol电子,所以是的质量是18g。
(3)考查电解池的有关计算。
阴极生成气体,说明铜离子全部析出,所以反应中转移电子是1mol/L×0.1L×2+1.12L÷22.4L/mol×2=0.3mol。
设消耗H2和O2的物质的量分别为x、y,则根据电子得失守恒可知
2H2 + O2
2mol 1mol 4mol
x y 0.3mol
解得:x="0." 15 mol y="0.075" mol

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
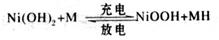
 2CO32-+6H2O,则下列说法正确的是
2CO32-+6H2O,则下列说法正确的是 CH3OH + H2O)
CH3OH + H2O)
 新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由该铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中酸性氧化物分解除去,转化流程如图所示:
新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由该铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中酸性氧化物分解除去,转化流程如图所示:
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3

