��Ŀ����
����Ŀ�������ݲ�ͬ��������ͭ������ͭ�Ļ������Ʒ�٢ڢۡ��ס��ҡ�����ͬѧ��ȡһ����Ʒ����ǿ�ȳ�ַ�Ӧ���ⶨ����Ʒ����ͭ������
(1)��ȡ2.56����Ʒ�٣����ڿ����м�ǿ�ȣ�����Ϊ����ͭ�Ͷ�������������0.448 L���壨��״�����������屻30 mLһ��Ũ����������ǡ����ȫ���գ���������ҺС�ĵ������ɵù���2.3�ˡ�����Ʒ������ͭ������Ϊ_____g����������Ũ��_______mol��L-1��
(2)��ȡ3.52����Ʒ�ڣ�Ͷ�������Ũ�����м��ȣ���ַ�Ӧ����Ʒȫ�����뷴Ӧ����Һʧ��8.44�ˡ���Ʒ������ͭ�����ʵ���Ϊ____mol����Ũ�����Ũ��Ϊ14.2 mol��L-1����Ӧ����Ũ����____mL��(��֪��Cu2S+14HNO3��2Cu(NO3)2+10NO2��+H2SO4+6H2O)
(3)��������Ʒ��ǿ�Ⱥ�ʣ��Ĺ���������ԭ��Ʒ��С��a g�����ù���Ϊ����ͭ������Ʒ������ͭ���ʵ���(n)Ϊ_________mol����Ҫ��������ͭ����������ȱ��_____________���ݣ����������Ϊb�ˣ�������ͭ������Ϊ___________��
���𰸡�0.96 1 0.02 23.9 0.0625a��![]() ��Ʒ������ b-6a ��
��Ʒ������ b-6a ��
��������
(1)����n=![]() ����SO2�����ʵ�����Ȼ������Sԭ���غ㡢������������CuS��������������ԭ���غ㡢�õ���������������������ơ��������Ƶ����ʵ������ٸ�����ԭ���غ�����������Ƶ����ʵ���Ũ�ȣ�
����SO2�����ʵ�����Ȼ������Sԭ���غ㡢������������CuS��������������ԭ���غ㡢�õ���������������������ơ��������Ƶ����ʵ������ٸ�����ԭ���غ�����������Ƶ����ʵ���Ũ�ȣ�
(2)CuS��Cu2S�����ᷢ����Ӧ��CuS+10HNO3=Cu(NO3)2+8NO2��+H2SO4+4H2O��Cu2S+14HNO3��2Cu(NO3)2+10NO2��+H2SO4+6H2O�����ݹ�����������Һʧ�������з���ʽ����CuS�����ʵ���������CuS��Cu2S������Ĺ�ϵʽ��������������
(3)CuS��Cu2S������Ӧ����CuO�����ݻ�ѧʽ֪��Cu2S����Է��������൱��2��CuO����Է������������Է�Ӧ�����м��ٵ������൱��CuS---CuO֮����ٵ��������ݴ˼���CuS�����ʵ�����Ҫ��������ͭ������������Ҫ֪����Ʒ�ܵ�����������m=n��M����CuS����������������ȥCuS��������������ͭ��������
(1) n(SO2)=![]() =
=![]() =0.02 mol����CuS�����ʵ���Ϊx mol��Cu2S�����ʵ���Ϊy mol����x+y=0.02��96x+160y=2.56�����x=0.01��y=0.01����m(CuS)=0.01 mol��96 g/mol=0.96 g���跴Ӧ����Na2SO3�����ʵ���Ϊa mol��NaHSO3�����ʵ���Ϊb mol��a+b=0.02��126a+104y=2.3�����a=0.01��b=0.01�����Ը�����ԭ���غ��n(NaOH)=2n(Na2SO3)+n(NaHSO3)=2��0.01 mol+0.01 mol=0.03 mol����NaOH��Һ�����ʵ���Ũ��c(NaOH)=
=0.02 mol����CuS�����ʵ���Ϊx mol��Cu2S�����ʵ���Ϊy mol����x+y=0.02��96x+160y=2.56�����x=0.01��y=0.01����m(CuS)=0.01 mol��96 g/mol=0.96 g���跴Ӧ����Na2SO3�����ʵ���Ϊa mol��NaHSO3�����ʵ���Ϊb mol��a+b=0.02��126a+104y=2.3�����a=0.01��b=0.01�����Ը�����ԭ���غ��n(NaOH)=2n(Na2SO3)+n(NaHSO3)=2��0.01 mol+0.01 mol=0.03 mol����NaOH��Һ�����ʵ���Ũ��c(NaOH)=![]() =1 mol/L��
=1 mol/L��
(2)��CuS�����ʵ���Ϊc mol��Cu2S�����ʵ���Ϊd mol������ݹ���������Ϊ3.52 g�ɵã�96c+160d=3.52������CuS��Cu2S�����ᷢ����Ӧ��CuS+10HNO3=Cu(NO3)2+8NO2��+H2SO4+4H2O��Cu2S+14HNO3��2Cu(NO3)2+10NO2��+H2SO4+6H2O����Һʧ�ؿɵã�272c+300d=8.44����ʽ���������c=0.02 mol��d=0.01 mol��������Ʒ����CuS�����ʵ���Ϊ0.02 mol��Cu2SΪ0.01 mol����CuS+10HNO3=Cu(NO3)2+8NO2��+H2SO4+4H2O��֪��0.02 molCuS��ȫ��Ӧ��Ҫ��������ʵ���n(HNO3)=0.02mol��10=0.2 mol������Cu2S+14HNO3��2Cu(NO3)2+10NO2��+H2SO4+6H2O��֪��0.01 mol Cu2S��ȫ��Ӧ��Ҫ��������ʵ���n(HNO3)=0.01 mol��14=0.14 mol������Ҫ�ܵ���������ʵ���n(HNO3)��=0.2 mol+0.14 mol=0.34 mol�����Ҫ��������V(HNO3)��=![]() =0.0239 L=23.9 mL��
=0.0239 L=23.9 mL��
(3)CuS��Cu2S������Ӧ����CuO�����ݻ�ѧʽ֪��Cu2S����Է��������൱��2��CuO����Է������������Է�Ӧ�����м��ٵ������൱��CuS---CuO֮����ٵ�����������n(CuS)=![]() mol=0.0625a mol��m(CuS)=96 g/mol��
mol=0.0625a mol��m(CuS)=96 g/mol��![]() mol=6a g������m(Cu2S)=bg-6a g=(b-6a) g��
mol=6a g������m(Cu2S)=bg-6a g=(b-6a) g��

 ���������������Բ��������ϵ�д�
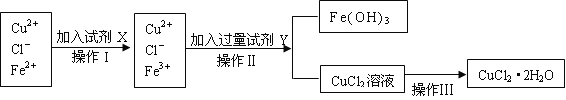
���������������Բ��������ϵ�д�����Ŀ���Ȼ�ͭ����(CuCl2��2H2O)�к���FeCl2���ʣ�Ϊ�Ƶô������Ȼ�ͭ���壬���Ƚ����Ƴ�ˮ��Һ���ٰ���ͼ��ʾ�IJ�����������ᴿ��
������±�������������ա�
�������↑ʼ����ʱ��pH | �������������ȫʱ��pH | |
Cu2�� | 4.7 | 6.7 |
Fe2�� | 7.0 | 9.0 |
Fe3�� | 1.9 | 3.7 |
(1)����I����X��Ŀ����_________________��
(2)�������ʶ�������ΪX���ʺϱ�ʵ���X���ʿ�����(��ѡ��)_________ ��
A��KMnO4 B��NaClO C��H2O2 D��Cl2
(3)����II��Y�Լ�Ϊ____________(�ѧʽ)����������Һ��pH��______��Χ��
(4)ʵ����������CuCl2��Һʱ���������_________(����������)��������(�������������й����ӷ���ʽ��ʾ)_________________ __________��
(5)����CuCl2��Һ�������գ��õ��Ĺ�����_________________(�ѧʽ)����Ҫ����ˮCuCl2���������������_________________________��
����Ŀ���ں��º��ݵ��ܱ������а����±��ס��ҡ������ַ�ʽ�ֱ�Ͷ�ϣ�������Ӧ��3H2��g����N2��g�� ![]() 2NH3��g������ü�������H2��ƽ��ת����Ϊ 40%������˵����ȷ���ǣ� ��.
2NH3��g������ü�������H2��ƽ��ת����Ϊ 40%������˵����ȷ���ǣ� ��.
N2��mol�� | H2��mol�� | NH3��mol�� | |
�� | 1 | 3 | 0 |
�� | 0.5 | 1.5 | 1 |
�� | 0 | 0 | 4 |
A.�������з�Ӧ���������
B.�ﵽƽ��ʱ���ס��ҡ�����������NH3��������Ĵ�С˳�ף���>��
C.���е�NH3ת����Ϊ40%
D.�����ں��º�ѹ���ܱ��������У�ƽ������������ٳ���4 mol NH3�����´ﵽƽ��ʱ����ϵ��NH3�����������