题目内容
【题目】回答下列问题:
(1)现有NaOH、Na2CO3、Ba(OH)2三种无色溶液,选用一种试剂把他们鉴别出来,并写出反应的离子方程式。
①鉴别试剂____________;
②反应的离子方程式__________________、________________、________________。
(2)某工厂的废水中含有大量的FeSO4、较多的Cu2+和少量Na+。为了减少污染并变废为宝,工厂计划从该废水中回收FeSO4和Cu。请根据流程图,在方框和括号内填写物质的名称(或主要成分的化学式)或操作方法,完成回收FeSO4和Cu的简单实验方案。_____________、_____________、_____________、_____________、_____________、_____________、_____________,
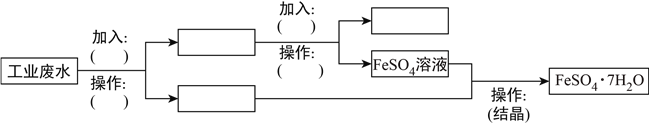
【答案】 H2SO4 OH-+H+=H2O 2H++![]() =CO2↑+H2O Ba2++
=CO2↑+H2O Ba2++![]() +2H++2OH-=BaSO4↓+2H2O Fe 过滤 Fe、Cu FeSO4 H2SO4 过滤 Cu;
+2H++2OH-=BaSO4↓+2H2O Fe 过滤 Fe、Cu FeSO4 H2SO4 过滤 Cu;
【解析】(1)①稀硫酸与碳酸钠反应放出气体,与氢氧化钡反应产生白色沉淀,与氢氧化钠反应无明显实验现象,因此鉴别试剂H2SO4;②反应的离子方程式依次为OH-+H+=H2O、2H++CO32-=CO2↑+H2、Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O。(2)工业废水中含有大量的FeSO4、较多的Cu2+和少量Na+,根据流程图中可以知道,完成回收硫酸亚铁和铜,应先加过量铁粉把铜置换出来,Cu2++Fe=Fe2++Cu,分离固体和液体用过滤,过滤后废水中剩下FeSO4和少量的Na+,铁与硫酸反应,与铜不反应,铁粉、铜中加H2SO4,发生反应:Fe+H2SO4=FeSO4+H2↑,得到FeSO4,第三步操作为蒸发、浓缩、结晶、过滤,可得到FeSO4·7H2O。

【题目】利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为 .
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5 , 装置如图所示,其中Y为CO2 . 写出石墨I电极上发生反应的电极反应式 .
在电解池中生成N2O5的电极反应式为 . 
(3)以甲醇燃料电池为电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为 L.
(4)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)2NH3(g),其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | … |
K/(molL﹣1)2 | 4.1×106 | K1 | K2 | … |
完成下列问题:
①已知该反应能够自发进行,试比较K1、K2的大小:K1K2(填“>”、“=”或“<”);
②在同温同压时判断该反应达到化学平衡状态的依据是(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(5)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式;
②盐酸肼水溶液中离子浓度的排列顺序不正确的是(填序号).
A.c(Cl﹣)>c(N2H62+)>c(OH﹣)>c(H+)
B.c(Cl﹣)>c([N2H5H2O+])>c(H+)>c(OH﹣)
C.2c(N2H62+)+c([N2H5H2O]+)+c(H+)=c(Cl﹣)+c(OH﹣)
D.c(N2H62+)>c(Cl﹣)>c(H+)>c(OH﹣)
【题目】现将600mL稀硫酸等体积分为6份,并向其中5份中分别加入质量不等的Zn粒,并收集生成的氢气,有以下记录结果。(氢气的体积已折算为标准状况)
实验① | 实验② | 实验③ | 实验④ | 实验⑤ | |
Zn质量(g) | 5.0 | 8.0 | 12 | 14 | 16 |
H2体积(L) | 1.72 | 4.14 | 4.48 | 4.48 |
(1)由实验结果可推知,此稀硫酸的物质的量浓度为____________。
(2)实验②收集到H2的体积为____________。
(3)若向第6份稀硫酸中不断加入Zn粒,请在下图中画出H2体积(V)与Zn粒质量(m)的关系图像____________。