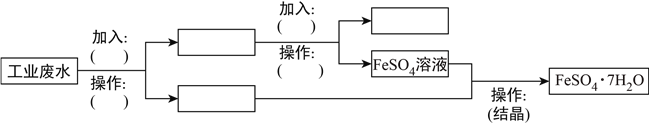
题目内容
【题目】下列图示与对应的叙述不相符的是( ) 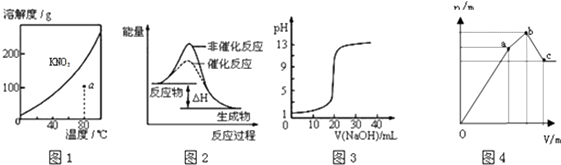
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000molL﹣1NaOH溶液滴定20.00mL0.1000molL﹣1醋酸溶液得到滴定曲线
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
【答案】C
【解析】解:A、KNO3的溶解度随着温度的升高而升高,溶解度曲线上的点是饱和溶液,曲线以下的a点是不饱和溶液,故A正确;
B、反应物的总能量大于生成物的总能量,则反应是放热反应,加入催化剂会降低活化能,改变反应的速率,但反应热不改变,故B正确;
C、0.1000molL﹣1NaOH溶液滴定20.00mL 0.1000molL﹣1CH3COOH溶液,消氢氧化钠溶液体积为0时,醋酸为弱电解质,醋酸溶液的pH大于1,图象中醋酸的pH=1与实际不符,故C错误;
D、开始滴加同时发生反应为SO42﹣+Ba2+=BaSO4↓,Al3++3OH﹣=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH﹣ , 即加入0.015molBa(OH)2 , 加入的Ba2+为0.015mol,SO42﹣未完全沉淀,此时溶液含有硫酸铵、硫酸铝;(开始到a)再滴加Ba(OH)2 , 生成BaSO4沉淀,发生反应为SO42﹣+Ba2+=BaSO4↓,NH4++OH﹣=NH3H2O,所以沉淀质量继续增加;当SO42﹣完全沉淀时,共需加入0.02molBa(OH)2 , 加入0.04molOH﹣ , Al3+反应掉0.03molOH﹣ , 生成Al(OH)30.01mol,剩余0.01molOH﹣恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液;(a到b)继续滴加Ba(OH)2 , Al(OH)3溶解,发生反应Al(OH)3+OH﹣=AlO2﹣+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2 , 此时溶液为氨水与偏铝酸钡溶液,(b到c),故D正确.
故选C.
【考点精析】通过灵活运用酸碱中和滴定,掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点即可以解答此题.