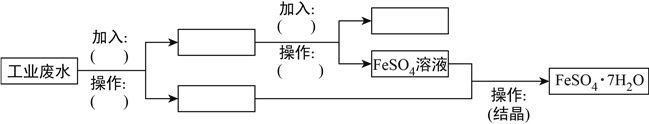
题目内容
【题目】下列制绿矾的方法最适宜的是用
A.FeO与稀H2SO4
B.Fe屑与稀H2SO4
C.Fe(OH)2与稀H2SO4
D.Fe2(SO4)3与Cu粉
【答案】B
【解析】
空气中的氧气能够氧化Fe2+,加入铁粉可以将铁离子转化为亚铁离子,据此分析。
A.FeO与稀H2SO4生成硫酸亚铁,Fe2+易被氧化成三价铁,A错误;
B.Fe屑与稀H2SO4反应生成硫酸亚铁,加入铁粉可以防止二价铁被氧化,B正确;
C.Fe(OH)2与稀H2SO4反应生成硫酸亚铁,易被空气氧化,C错误;
D.Fe2(SO4)3与Cu粉反应生成硫酸亚铁和硫酸铜,产品不纯,D错误;
答案选B。

【题目】尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示. 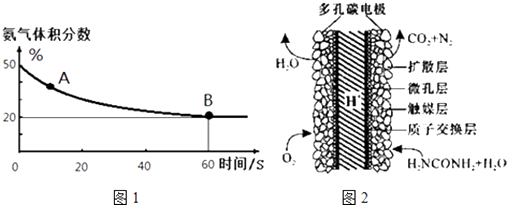
A点的正反应速率v正(CO2)B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);氨气的平衡转化率为 .
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)将实验测得的不同温度下的平衡数据列于表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度 (10﹣3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①关于上述反应的焓变、熵变说法正确的是 .
A.△H<0,△S<0B.△H>0,△S<0 C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=;(填具体数值)NH4+水解平衡常数值为 .
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式: .