��Ŀ����
����Ŀ������N2��H2����ʵ��NH3�Ĺ�ҵ�ϳɣ������ֿ��Խ�һ���Ʊ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش��������⣺
��1����֪��N2��g��+O2��g���T2NO��g����H=+180.5kJ/mol
N2��g��+3H2��g��2NH3��g����H=��92.4kJ/mol
2H2��g��+O2��g��=2H2O��g����H=��483.6kJ/mol
д����������������ȫ����һ�����������ˮ�������Ȼ�ѧ����ʽΪ ��
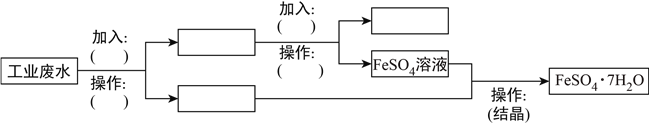
��2��N2O5��һ�������������������ʺ��Ʊ��ܵ����ǵĹ�ע������H2��O2��������Na2CO3��ɵ�ȼ�ϵ�أ����õ�ⷨ�Ʊ�N2O5 �� װ����ͼ��ʾ������YΪCO2 �� д��ʯīI�缫�Ϸ�����Ӧ�ĵ缫��Ӧʽ ��
�ڵ���������N2O5�ĵ缫��ӦʽΪ �� 
��3���Լ״�ȼ�ϵ��Ϊ��Դ���ö��Ե缫��ⱥ��NaCl��Һʱ��ÿ����0.2mol CH3OH�����������������������Ϊ L��
��4����һ��������ܱ������У��������»�ѧ��Ӧ��N2��g��+3H2��g��2NH3��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t/K | 298 | 398 | 498 | �� |
K/��molL��1��2 | 4.1��106 | K1 | K2 | �� |
����������⣺
����֪�÷�Ӧ�ܹ��Է����У��ԱȽ�K1��K2�Ĵ�С��K1K2�����������=����������
����ͬ��ͬѹʱ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������������ţ���
A��2v��H2��������=3v��NH3�����棩 B��2v��N2��������=v��H2�����棩
C��������ѹǿ���ֲ��� D�����������ܶȱ��ֲ���
��5�������£�N2H6Cl2����һ����Ҫ�Ļ���ԭ�ϣ��������ӻ����������ˮ����Һ�����ԣ�ˮ��ԭ����NH4Cl���ƣ�
��д�������µ�һ��ˮ�ⷴӦ�����ӷ���ʽ��
��������ˮ��Һ������Ũ�ȵ�����˳����ȷ����������ţ���
A��c��Cl������c��N2H62+����c��OH������c��H+��
B��c��Cl������c��[N2H5H2O+]����c��H+����c��OH����
C��2c��N2H62+��+c��[N2H5H2O]+��+c��H+��=c��Cl����+c��OH����
D��c��N2H62+����c��Cl������c��H+����c��OH����
���𰸡�
��1��4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=��905.0kJ/mol
��2��H2+CO32����2e��=CO2+H2O��N2O4+2HNO3��2e��=2N2O5+2H+
��3��13.44
��4������AC
��5��N2H62++H2O?[N2H5?H2O]++H+��BCD
���������⣺��1.��N2��g��+O2��g���T2NO��g����H=+180.5kJ/mol ��
N2��g��+3H2��g���T2NH3��g����H=��92.4kJ/mol ��
2H2��g��+O2��g���T2H2O��g����H=��483.6kJ/mol ��
�ɸ�˹���ɢ١�2���ڡ�2+�ۡ�3�ã�4NH3��g��+5O2��g���T4NO��g��+6H2O��g����H=905.0kJ/mol�� ���Դ��ǣ�4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=��905.0kJ/mol��
��2.��ȼ��ԭ����У�������ȼ��ʧ���Ӻ�̼������ӷ�Ӧ���ɶ�����̼��ˮ���缫��ӦʽΪH2+CO32����2e��=CO2+H2O��N2O5�е�Ԫ�صĻ��ϼ���+5�ۣ��������е�Ԫ��Ҳ��+5�ۣ����Ӧ�����������N2O5 �� ���������������ɣ��ݵ缫��Ӧ���ӷŵ�˳���֪����������2H++2e��=H2���ķ�Ӧ��������ΪN2O4+2HNO3��2e��=2N2O5+2H+ �� ���Դ��ǣ�H2+CO32����2e��=CO2+H2O��N2O4+2HNO3��2e��=2N2O5+2H+��
��3.���øõ������Դ���ö��Ե缫��ⱥ��NaCl��Һʱ��CH3OH��6e��+8OH��=CO32��+6H2O��ÿ����0.2mol CH3OH��ת�Ƶ���1.2mol�������缫��ӦΪ2H++2e��=H2���������������������=0.6mol��22.4L/mol=13.44L�����Դ��ǣ�13.44��
��4.���ٸ÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ���������Ũ�ȼ�С����Ӧ��Ũ����������K1��K2 �� ���Դ��ǣ�������A����ͬ���ʵ����淴Ӧ����֮�ȵ����������֮����ƽ��״̬����֤�����淴Ӧ������ȣ���A��ȷ��
B����ͬ���ʵ����淴Ӧ����֮�ȵ����������֮����ƽ��״̬��2v��N2��������=v��H2�����棩����ƽ��״̬����B����
C��������ѹǿ���䣬��������ʵ������䣬�÷�Ӧ��ƽ��״̬����C��ȷ��
D����������ܱ������з�Ӧ���������䣬������䣬�ܶ�ʼ�ղ��䣬��D����ѡ��AC��
��5.������ˮ����NH4Cl���ƣ���N2H62+ˮ����H2O�������ɵ�OH�� �� ��ˮ�����ӷ�ӦΪN2H62++H2O[N2H5H2O]++H+ ��
���Դ��ǣ�N2H62++H2O[N2H5H2O]++H+��
��A���������µĻ�ѧʽΪN2H6Cl2 �� ��c��Cl������c��N2H62+������ˮ�������ԣ���c��H+����c��OH��������ˮ��ij̶Ⱥ�������c��N2H62+����c��H+����������Ũ�ȵĴ�С��ϵΪc��Cl������c��N2H62+����c��H+����c��OH��������A��ȷ��
B����ˮ�ⷽ��ʽN2H62++H2O[N2H5H2O]++H+ �� ��֪c��[N2H5H2O+]��=c��H+������B����
C�����ݵ���غ�ɵã�2c��N2H62+��+c��[N2H5H2O+]��+c��H+��=c��Cl����+c��OH��������C����
D������A��֪��ȻD����D�������Դ��ǣ�BCD��
�����㾫����������Ŀ����֪���������û�ѧƽ��״̬���жϵ����֪ʶ���Եõ�����Ĵ𰸣���Ҫ����״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ�

 ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д�����Ŀ����¯������ұ��������Ҫ��������������Ҫ��ӦΪ��
Fe2O3��s��+3CO��g��2Fe��s��+3CO2��g����H=a kJ mol��1
��1����֪����Fe2O3��s��+3C��ʯī��=2Fe��s��+3CO��g����H1=+489.0kJ mol��1
��C��ʯī��+CO2��g��=2CO��g����H2=+172.5kJ mol��1
��a=kJ mol��1 ��
��2��ұ������Ӧ��ƽ�ⳣ������ʽK= �� �¶����ߺ�Kֵ������������䡱��С������
��3����T��ʱ���÷�Ӧ��ƽ�ⳣ��K=64����2L�����ܱ����������У��ֱ��±���ʾ�������ʣ���Ӧ����һ��ʱ���ﵽƽ�⣮
Fe2O3 | CO | Fe | CO21 | |
��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
��/mol | 1.0 | 2.0 | 1.0 | 1.0 |
�ټ�������CO��ƽ��ת����Ϊ ��
������˵����ȷ����������ĸ����
a���������������ܶȺ㶨ʱ����־��Ӧ�ﵽƽ��״̬ b����������CO��ƽ��ת���ʴ����ҵ�
c���ס��������У�CO��ƽ��Ũ��֮��Ϊ2��3 d������Fe2O3�������CO��ת����
��4����ȡһ����ʩ�ɷ�ֹ������ʴ������װ���е��ձ����ʢ�е�Ũ�ȡ��������NaCl��Һ��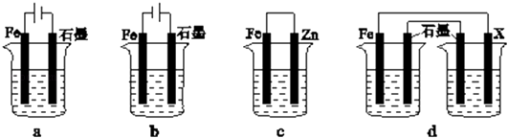
����a��cװ���У��ܱ���������������ĸ����
������dװ�ñ�������X���ĵ缫����Ӧ���������ƣ���