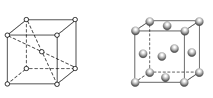
题目内容
【题目】每天早上5:30起床学习化学会使人变得更加可爱聪明美丽帅气,而丑陋的人则会被尿憋醒,尿的主要成分是尿素,化学式为CO(NH2)2,结构可表示为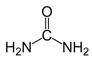 下列有关说法正确的是
下列有关说法正确的是
A.1mol CO(NH2)2分子中含有3mol δ键
B. CO(NH2)2分子中C原子、N原子的轨道杂化类型是均为sp3
C.组成尿素的四种元素第一电离能由大到小的顺序是O、N、C、H
D.根据结构推测,尿素可能易溶于水,熔沸点高于丙酮![]()
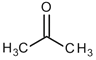
![]()
【答案】D
【解析】
A.单键是δ键,双键中一个δ键,所以1mol CO(NH2)2分子中含有7molδ键,故A错误;
B.CO(NH2)2分子中C原子形成三个δ键、N原子形成三个δ键和一对孤对电子对,所以C原子、N原子的轨道杂化类型分别为sp2、sp3,故B错误;
C.同一周期元素,其第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,这几种元素第一电离能大小顺序是N > O > C > H,故C错误;
D.尿素分子与水分子间易形成氢键,所以尿素可能易溶于水,尿素分子间也可形成氢键,所以尿素熔沸点高于丙酮,故D正确。
综上所述,答案为D。

练习册系列答案
相关题目