题目内容
4.由氢气和氯气组成的混合气体(氯气过量),经光照充分反应后,通入100mL 1.0mol•L-1的NaOH溶液中.下图中图甲表示溶液中某种离子的物质的量随通入气体体积的变化曲线,图乙表示溶液的导电性随气体体积的变化曲线.请填空: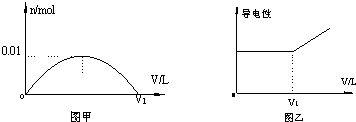
(1)图甲表示溶液中ClO-离子的变化曲线;
(2)对溶液进行导电性实验,当通入的混合气体体积大于V1时,引起的溶液导电性明显增强的主要阴、阳离子为Cl-和H+;
(3)当n=0.01mol时,光照前的混合气体中H2与Cl2的物质的量之比为4:5.
分析 (1)氯气过量,光照后为HCl与氯气混合气体,HCl和Cl2都与NaOH溶液反应:Cl2+2NaOH=NaCl+NaClO+H2O、HCl+NaClO=NaCl+HClO,根据图象知,随着混合气体的通入,某种离子的物质的量先增大后减小,该离子是ClO-;
(2)ClO-浓度最小,即其转化为HClO后,再通入气体,溶液导电能力逐渐增大,说明氯气和氢氧化钠溶液反应完全后HCl仍然有剩余,氯化氢溶于水生成盐酸;
(3)当n(ClO-)=0.01 mol时,氢氧化钠完全反应,发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,NaOH+HCl=NaCl+H2O,根据方程式计算反应后氯气、HCl物质的量,再结合H2+Cl2=2HCl计算.
解答 解:(1)氯气过量,光照后为HCl与氯气混合气体,HCl和Cl2都与NaOH溶液反应,Cl2+2NaOH=NaCl+NaClO+H2O、HCl+NaClO=NaCl+HClO,根据图象知,随着混合气体的通入,某种离子的物质的量先增大后减小,该离子是ClO-,故答案为:ClO-;
(2)ClO-浓度最小,即其转化为HClO后,再通入气体,溶液导电能力逐渐增大,说明氯气和氢氧化钠溶液反应完全后HCl仍然有剩余,氯化氢溶于水生成盐酸,氯化氢在水分子的作用下电离出氢离子和氢氧根离子而使溶液导电性增强,故答案为:Cl-和H+;
(3)氢氧化钠的物质的量=0.1L×1mol/L=0.1mol,
当n(ClO-)=0.01 mol时,氢氧化钠完全反应,则:
Cl2+2NaOH=NaCl+NaClO+H2O,
0.01mol 0.02mol 0.01mol
NaOH+HCl=NaCl+H2O,
(0.1-0.02)mol 0.08 mol
H2 +Cl2 =2 HCl
0.04mol 0.04mol 0.08mol,
因此光照前的混合气体中H2和Cl2的物质的量之比为0.04mol:(0.01mol+0.04mol)=4:5,
故
故答案为:4:5.
点评 本题考查化学方程式计算、混合物计算,明确图象中阶段发生的反应是关键,难度较大.

| A. | 糖尿病患者不宜食用含糖量高的食物 | |
| B. | 人体如果摄入的糖类过多,它在体内转化为多余的脂肪,引起肥胖 | |
| C. | 如果人在较长时间内未进食,人体就无法摄取能量 | |
| D. | 人体摄入的蛋白质,在酶的作用下水解,最终生成氨基酸 |
| A. | 3.0g | B. | 3.5g | C. | 5.5g | D. | 5.6g |
| A. | N2 | B. | CaCl2 | C. | NaOH | D. | H2O |
| A. | 溴苯中滴入AgNO3 溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 用醋酸除去水垢:CaCO3+2H+=CO2↑+H2O+Ca2+ | |
| C. | 氯气与甲烷在光照下反应CH4+Cl2$\stackrel{光照}{→}$CCl4+2H2 | |
| D. | 实验室用液溴和苯在催化剂作用下制溴苯: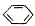 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$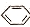 -Br+HBr -Br+HBr |
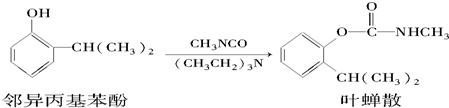
下列有关说法正确的是( )
| A. | 叶蝉散的分子式是C11H16NO2 | |
| B. | 邻异丙基苯酚与FeCl3溶液反应生成蓝色沉淀 | |
| C. | 叶蝉散在强酸、强碱性环境中能稳定存在 | |
| D. | 可用FeCl3溶液检验叶蝉散中是否含邻异丙基苯酚 |
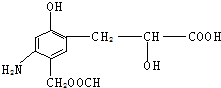 分析下列有机物的结构,判断该有机物可能发生的反应类型:( )
分析下列有机物的结构,判断该有机物可能发生的反应类型:( )①加成反应 ②消去反应 ③取代反应 ④水解反应 ⑤中和反应 ⑥显色反应 ⑦氧化反应.
| A. | 除④外其余都有 | B. | 全部 | C. | 只④⑤⑥⑦ | D. | 只①③⑤⑥⑦ |
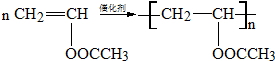 .
.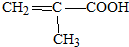 .
.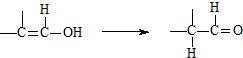
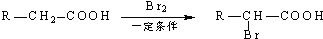
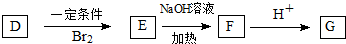
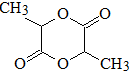 .写出N发生消去反应的化学方程式:CH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.
.写出N发生消去反应的化学方程式:CH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O. 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析: