题目内容
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量C及SiO2)为原料制备的流程如下:
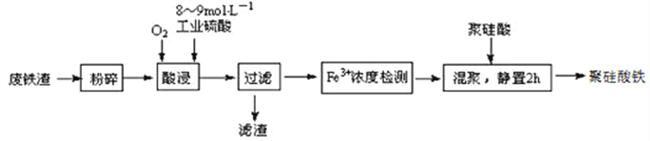
已知:在一定温度下酸浸时Fe3+在pH=2开始沉淀,pH=3.7沉淀完全
(1)废铁渣进行“粉碎”的目的是___________________________________________________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如下表所示:
温度℃ | 40 | 60 | 80 | 100 | 120 |
铁浸取率 | 50 | 62 | 80 | 95 | 85 |
①请写出酸浸过程中Fe3O4发生的离子反应方程式__________________________________。
②硫酸酸浸时应控制溶液的pH____________,其原因是_________________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是___________________。
(3)上述过滤步骤的滤液的主要成分为____________(填化学式)。
(4)Fe3+浓度定量检则,是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为____________。
【答案】 增大接触面积,同时增大浸取时的反应速率和提高铁浸取率 4Fe3O4+O2+36H+=12Fe3++18H2O 小于2 pH≥2时将有部分Fe3+沉淀损失 温度超过100℃明显加快了Fe3+水解反应的速率,导致Fe3+浓度降低 Fe2(SO4)3 和H2SO4 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
【解析】试题分析:(1)废铁渣进行“粉碎”可以增大废铁渣与反应物的接触面积;(2)①酸浸过程中Fe3O4被氧气完全氧化为Fe3+;②Fe3+在pH=2开始沉淀,硫酸酸浸时要保证Fe3+不沉淀;③升高温度,Fe3+水解平衡正向移动;(3)废铁渣中只有Fe3O4与氧气、硫酸反应生成了Fe2(SO4)3和水;(4)在酸性条件下, Cr2O72-被还原为Cr3+,Fe2+被氧化为Fe3+。
解析:(1)废铁渣进行“粉碎”可以增大废铁渣与反应物的接触面积,增大浸取时的反应速率和提高铁浸取率;(2)①酸浸过程中Fe3O4被氧气完全氧化为Fe3+,反应离子方程式是4Fe3O4+O2+36H+=12Fe3++18H2O;②Fe3+在pH=2开始沉淀,硫酸酸浸时要保证Fe3+不沉淀,所以要控制PH小于2;③升高温度,Fe3+水解平衡正向移动,生成氢氧化铁,所以温度超过100℃时,铁浸取率反而减小;(3)废铁渣中只有Fe3O4与氧气、硫酸反应生成了Fe2(SO4)3和水,所以滤液的成分是Fe2(SO4)3 和H2SO4;(4)在酸性条件下, Cr2O72-被还原为Cr3+,Fe2+被氧化为Fe3+,反应的离子方程式是6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案