题目内容
【题目】向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如下图所示。则下列分析与判断正确的是(不计CO2的溶解)
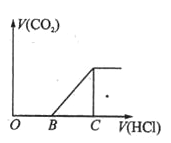
A.若OB=0,则溶液M为Na2CO3溶液
B.若OB=BC,则形成溶液M所发生的离子反应方程式为:OH-+CO2=HCO3-
C.若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
D.若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3-
【答案】C
【解析】
试题分析:向Na2CO3溶液中逐滴加入盐酸,反应原理为:Na2CO3 + HCl = NaCl + NaHCO3,NaHCO3 + HCl = NaCl + CO2↑ + H2O。A.若OB = 0,表明开始滴加盐酸就有气体生成,则M中的溶质NaHCO3,反应为CO2 + OH— = HCO3—,A项错误;B.若OB = BC,说明生成HCO3—消耗的H + 与HCO3—产生CO2消耗的H + 相等,则M中的溶质为Na2CO3,生成碳酸钠发生的反应为2OH- + CO2 = CO32-,B项错误;C.3OB = BC,M中溶质为Na2CO3和NaHCO3,因为Na2CO3~NaHCO3,所以c(NaHCO3) = 2c(Na2CO3),C项正确;D.OB>BC,说明不产生CO2消耗H + 大于产生CO2消耗的H + 量,M中溶质应为NaOH和Na2CO3,若OB<BC,说明不产生CO2消耗H+小于产生CO2消耗的H+量,M中溶质应为Na2CO3和NaHCO3,D项错误;答案选C。

【题目】如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将甲针筒内的物质压到乙针筒内,进行实验,对乙针筒里的现象所作的判断不正确的是( )
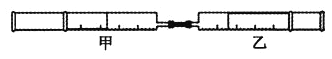
实验序号 | 甲针筒内物质 | 乙针筒内物质 | 乙针筒里的现象 |
A | HCl | AgNO3溶液 | 产生白色沉淀 |
B | NH3 | FeCl3溶液 | 出现红褐色沉淀 |
C | SO2 | BaCl2 | 产生白色沉淀 |
D | Cl2 | 紫色石蕊溶液 | 先变红后褪色 |