题目内容
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2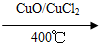 2Cl2+2H2O
2Cl2+2H2O
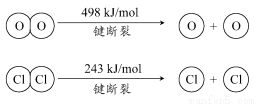
(1)已知:ⅰ.反应A中,4 molHCl被氧化,放出115.6 kJ的热量。
ⅱ.
①H2O的电子式是________。
②反应A的热化学方程式是______________________________________。
③断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”)________。
(2)对于反应A,下图是在4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
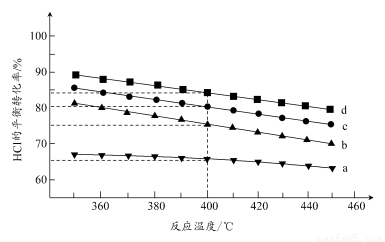
①曲线b对应的投料比是________。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是______________________________。
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是________。

②4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)
ΔH=-115.6 kJ/ mol
③32 强
(2)①4:1
②投料比越高,对应的反应温度越低
③30.8%
【解析】(1)③设H—O键的键能为x,H—Cl键的键能为y,则有-115.6=-2×243-4x+4y+498,化简得x-y=31.9,即断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为32 kJ,H2O中H—O键比HCl中H—Cl键强。
(2)①同一温度下,O2的浓度越大,HCl的平衡转化率越高,故曲线a、d分别对应n(HCl):n(O2)为6:1、1:1的情况,曲线b对应的投料比是4:1。
②在图上作一平行于温度轴的直线与曲线b、c、d相交,可以看出,当不同投料比下HCl的平衡转化率相同时,曲线b对应的温度最低,曲线d对应的温度最高。则可得出结论:投料比越高,对应的反应温度越低。
③此时HCl的平衡转化率为80%。设反应开始时n(HCl)=2a mol,n(O2)=a mol。
4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)
起始 2a mol a mol 0 0
转化 1.6a mol 0.4a mol 0.8a mol 0.8a mol
平衡 0.4a mol 0.6a mol 0.8a mol 0.8a mol
则平衡混合气体中Cl2的物质的量分数是
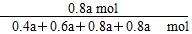 ×100%≈30.8%。
×100%≈30.8%。

某兴趣小组为探究外界条件对可逆反应A(g)+B(g)  C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
| A | B | C |
Ⅰ | 0.050 mol·L-1 | 0.050 mol·L-1 | 0.050 mol·L-1 |
Ⅱ | 0.070 mol·L-1 | 0.070 mol·L-1 | 0.098 mol·L-1 |
Ⅲ | 0.060 mol·L-1 | 0.060 mol·L-1 | 0.040 mol·L-1 |
Ⅳ | 0.080 mol·L-1 | 0.080 mol·L-1 | 0.12 mol·L-1 |
针对上述系列试验,下列结论中错误的是( )
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20 mol-1·L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与I比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,通过压缩容器的体积就可以实现