题目内容
在下图装置中,若通电一段时间后乙装置左侧电极质量增加,则下列说法错误的是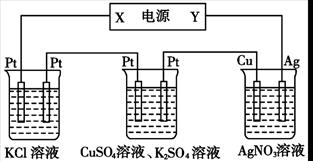
甲 乙 丙
| A.当甲装置中共产生标准状况下4.48 L气体时,Cu电极上质量增加43.2g |
| B.电解过程中装置丙的pH无变化 |
| C.向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态 |
| D.乙中左侧电极反应式:Cu2++2e-=Cu |
A
解析试题分析:由装置甲发生的反应可得两电极产生的气体体积相等,所以产生氢气为2.24 L,转移电子0.2 mol,则铜电极上生成Ag0.2 mol,质量为21.6 g,A选项不正确,装置内阴极析出银单质,阳极上的银失去电子变成银离子,理论上溶液的物质的量浓度不变,pH保持不变,B选项正确,装置甲中开始的反应为:2KCl+2H2O2KOH+H2↑+Cl2↑,故要使溶液恢复可通入适最HCl气体即可,C选项正确,乙装置的左侧电极质量增加,则左侧为阴极,由此可确定X极为负极,Y为正极,乙装置中铜离子放电,D选项正确。
考点:考查电化学基础,涉及电解和电镀。

练习册系列答案
相关题目
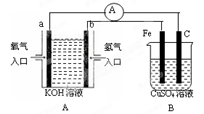
燃料电池能量利用率可高达80%,下列说法错误的是
| A.燃料电池的负极反应物是氢气、甲烷、乙醇等物质 |
| B.氢氧燃料电池常用于航天飞行器,产物水经过处理之后可供宇航员使用 |
| C.H2SO4作电解质,氢氧燃料电池的负极反应式H2+2OH--2e-=2H2O |
| D.乙醇燃料电池电解质为KOH,负极反应式C2H5OH+16OH--12e-=2CO32-+11H2O |
如图是某同学设计的原电池装置,下列叙述中正确的是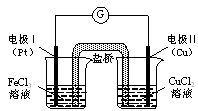
| A.电极Ⅰ上发生还原反应,作原电池的负极 |
| B.电极Ⅱ的电极反应式为: Cu2++2e-=" Cu" |
| C.该原电池的总反应为: 2Fe3++Cu= Cu2++2Fe2+ |
| D.盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
来自法国格勒诺布尔(Grenoble)约瑟夫·傅立叶大学的研究小组发明了第一块可为人体人造器官提供电能的可植入的葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶的作用下发生的总反应为C6H12O6+6O2=6CO2+6H2O(酸性环境),下列对该电池说法不正确的是
| A.该生物燃料电池不可以在高温下工作 |
| B.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+ |
| C.消耗1mol氧气则转移4mole-,H+会向负极移动 |
| D.今后的研究方向是怎样提高葡萄糖生物燃料电池的效率,从而在将来达到可以利用葡萄糖生物燃料电池为任何可植入医疗设备提供电能 |
等物质量浓度的FeBr3和CuCl2的混合溶液用惰性电极电解最初在负极发生反应的离子是( )
| A.Fe3+ | B.Br- | C.Cu2+ | D.Cl- |
下列有关物质的性质和该性质的应用均正确的是 ( )
| A.常温下浓硫酸与铝不发生反应,可在常温下用铝制容器贮藏贮运浓硫酸 |
| B.二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C.二氧化氯具有氧化性,可用于自来水的杀菌消毒 |
| D.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 |
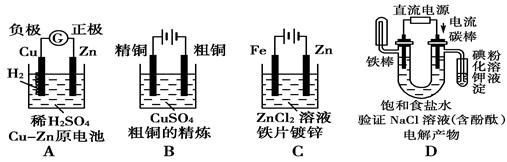
下列四种装置中,溶液的体积均为250 mL,开始时电解质溶液的浓度均为0.10mol/L,工作一段时间后,测得导线上均通过0.02 mol电子,若不考虑溶液体积的变化,则下列叙述正确的是
| A.工作一段时间后溶质的物质的量浓度①=②=③=④ |
| B.工作一段时间后溶液的pH:④>③=①>② |
| C.产生气体的总体积:④>②>①>③ |
| D.电极上析出的固体的质量:①>②>③>④ |