题目内容
如图是某同学设计的原电池装置,下列叙述中正确的是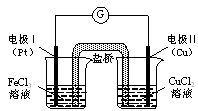
| A.电极Ⅰ上发生还原反应,作原电池的负极 |
| B.电极Ⅱ的电极反应式为: Cu2++2e-=" Cu" |
| C.该原电池的总反应为: 2Fe3++Cu= Cu2++2Fe2+ |
| D.盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
C
解析试题分析:A选项,电极Ⅰ 上发生的为还原反应,作为原电池正极。B选项,电极Ⅱ反应方程式为Cu+2e-= Cu2+。故错误。C选项,正确。D选项作用是保持电中性的和构成闭合回路。
考点:原电池原理。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为:Zn+2OH-=Zn(OH)2 +2e-; Ag2O +H2O +2e- ="2Ag" +2OH-。下列说法错误的是
| A.溶液中OH-向正极移动 | B.锌发生氧化反应 |
| C.氧化银是正极 | D.在电池放电过程中,电解质溶液的碱性增强 |
如图用石墨电极电解CuCl2溶液。下列分析正确的是( )
| A.a极发生还原反应 |
| B.每生成6.4 g Cu,转移电子0.2 mol |
C.阳极反应式: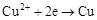 |
| D.在直流电源中电流从b流向a |
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2作溶剂,反应原理是4Li+FeS2=Fe+2Li2S。下列说法不正确的是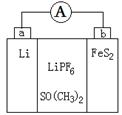
| A.该装置将化学能转化为电能 |
| B.电子移动方向是由a极到b极 |
| C.可以用水代替SO(CH3)2做溶剂 |
| D.b极反应式是FeS2+4Li++4e-=Fe+2Li2S |
Li-SOCl2电池可用于心脏起搏器。电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl +S +SO2。电池工作时,下列说法不正确的是 ( )
| A.锂电极发生氧化反应 |
| B.电子从锂电极通过外电路流向碳电极 |
| C.每生成1mol SO2转移4mol电子 |
| D.SOCl2既是氧化剂又是还原剂 |
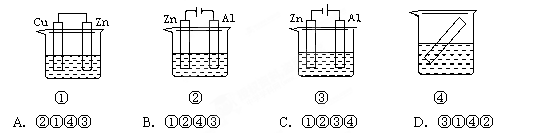
关于下列各装置图的叙述中,不正确的是 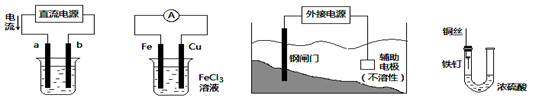
① ② ③ ④
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| C.为防止钢闸门被腐蚀,装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
在下图装置中,若通电一段时间后乙装置左侧电极质量增加,则下列说法错误的是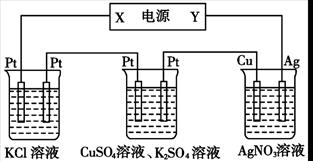
甲 乙 丙
| A.当甲装置中共产生标准状况下4.48 L气体时,Cu电极上质量增加43.2g |
| B.电解过程中装置丙的pH无变化 |
| C.向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态 |
| D.乙中左侧电极反应式:Cu2++2e-=Cu |
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )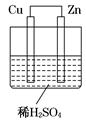
| 卡片号:2 2013.3.15,实验后的记录: ①Cu为负极,Zn为正极 ②Cu极上有气泡产生 ③SO42– 向Cu极移动 ④ 若有0.5mol电子流经导线,则可产生0.25mol气体 ⑤ 电子的流向是:Cu→Zn ⑥正极反应式:Cu +2e- = Cu2+ |