��Ŀ����
����Ŀ���״���һ�ֺܺõ�ȼ�ϣ���ҵ��һ���ں����ܱ������п��Բ������з�Ӧ�ϳɼ״���
CO(g)+2H2(g)![]() CH3OH(g) ��H
CH3OH(g) ��H
��1���жϷ�Ӧ�ﵽƽ��״̬��������(����ĸ��ţ� ��ͬ)__________��
A������CH3OH������������CO���������
B�����������ܶȲ���
C����������ƽ����Է�����������
D��CH3OH��CO��H2��Ũ�ȶ����ٱ仯
��2���±����������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)��
�¶� | 250 ��C | 300 ��C | 350 ��C |
K | 2.041 | 0.270 | 0.012 |
���ɱ��������жϦ�H__________0(��������� ����=��)��
��ij�¶��£���2 mol CO��6 mol H2����2 L ���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c(CO)=
0.2 mol L1����CO��ת����Ϊ_______����ʱ���¶�Ϊ______________��
��3��Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��_______��
a������ b���������
c������CO��Ũ�� d������H2��ѹ
e��������������ѹ f��������״�
��4��300 ��C��һ����ѹǿ�£�5mol CO������H2�ڴ�����������ǡ����ȫ��Ӧ�仯������Ϊ454kJ���ڸ��¶�ʱ�����ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
���� | �� | �� | �� | |
��Ӧ��Ͷ���� | 1 mol CO�� 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
ƽ��ʱ���� | CH3OH��Ũ�� / (mol L1) | c1 | c2 | c3 |
��Ӧ�������仯 | a kJ | b kJ | c kJ | |
��ϵѹǿ/ Pa | p1 | p2 | p3 | |
��Ӧ���ת���� | ��1 | ��2 | ��3 | |
����˵����ȷ����_________��
A��2 c1>c3 B��a+b<90.8
C��2p2 <p3 D����1 +��3<l
��5��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С�
ʵ���� | T/�� | n(CO)/n(H2) | p/MPa |
1 | 150 | 1/3 | 0.1 |
2 | a | 1/3 | 5 |
3 | 350 | b | 5 |
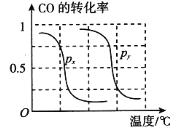
�����ϱ���ʣ�������������a=_________��b=_________��
�����ݷ�Ӧ���ص㣬��ͼ����ѹǿ�ֱ�Ϊ0.1 MPa��5 MPa��CO��ת�������¶ȱ仯������ͼ����ָ��ͼ�е�ѹǿpx=_________MPa��
���𰸡���1��CD ��2������ ��80% 250�� ��3��df ��4��D ��5����150 1/3 ��0.1
����������1���жϻ�ѧ��Ӧƽ��״̬�Ļ��������������滯ѧ��Ӧ������ȡ�Aѡ�����CH3OH�����ʺ�����CO�����ʾ�Ϊ����Ӧ���ʣ����ж������淴Ӧ���ʵĹ�ϵ������Bѡ���ϵ���������ʵ����������䣬������䣬���ܶȲ��䣬����Ӧ�������ܶȺ㶨������Cѡ���ϵ������������������䣬����Ӧ�����л����������ʵ������ϱ仯����ƽ����Է�����������ʱ��˵�������ʵ����ʵ������䣬�����淴Ӧ������ȣ�C��ȷ��Dѡ������ʵ�Ũ�Ȳ���ʱ��˵�������淴Ӧ������ȣ�D��ȷ��
��2�����ɱ������ݿ�֪���¶����ߣ�K��С��˵������ƽ�����淴Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ����H��0������֪����ʼʱCO��Ũ��Ϊ��2mol/2L=l mol L1��H2��Ũ��Ϊ6 mol/2 L = 3 mol L1��ƽ��ʱCO��Ũ��Ϊ0.2 mol L1����CO��Ũ�ȱ仯Ϊ1 mol L1 0.2mol L1=0.8 mol L1��CO��ת����Ϊ(0.8 mol L1/1 mol L1)��100%=80%��
���ݻ�ѧ����ʽ������
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
1 2 1
0.8 mol L1 2��0.8 mol L1
ƽ��ʱH2��Ũ��Ϊc(H2)= 3 mol L1 2��0.8 mol L1 =1.4mol L1��ƽ��ʱCH3OH��Ũ��Ϊc(CH3OH)= 0.8 mol��L1��K= (0.8 mol��L1 )/[(0.2 mol��L1)�� (1.4 mol��L1)2]=2.04����������ձȽ����ó���Ӧ��Ϊ250 ����
��3������ƽ�����淴Ӧ�����ƶ���a���������ı�ƽ��״̬��b��������CO��Ũ�ȣ�ƽ���������ƶ�����CO���Ӳ��ֵ�ת����С��ԭCO��ת���ʣ�����ת���ʼ�С��c������H2��H2��Ũ������ƽ���������ƶ���CO��ת��������d�ԣ�����������壬�����ʵ�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���e��������״����������Ũ�ȼ�С��ƽ�������ƶ���CO��ת��������f�ԡ�
��4��Aѡ��������ij�ʼ��Ӧ�ﻻ���CO��H2Ϊ2 mol CO ��4 mol H2�����ס�����Ӧ��ת������ͬ��2c1=c3�����ڱ���ѹǿ���ڼ�ѹǿ��ƽ�������ƶ�������CH3OH��ת���ʴ��ڼף���2c1��c3��ѡ�����Bѡ��ס�����ƽ��״̬��ͬ����ת���ų�����������ת�����յ�����֮���൱�ڼ���ȫ��ת���������仯����a+b=454 kJ/5=90.8kJ��ѡ�����Cѡ����ҡ����м״���ת������ͬ��2p2=p3������ѹǿ��ѹǿ���״���ת���ʼ�С����2p2��p3��ѡ�����Dѡ���1+��2 = 1������2����3������1+��3��l��ѡ����ȷ��
��5����Ȼ��ͬѧͨ�������Ʊ�������̽����������Ի�ѧƽ���Ӱ�죬̽����ǰ��ֻ���Ǹı�һ���������������������䣬�ɴ˿ɵó�a = 150��b=l/3�����������Ӧ��һ�����������С�ķ�Ӧ��ѹǿԽ��CO��ת����Ҳ���ɴ˿ɵ�px=0.1 MPa��
