【题目】甲醇是一种很好的燃料,工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到平衡状态的依据是(填字母序号, 下同)__________。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
温度 | 250 °C | 300 °C | 350 °C |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断ΔH__________0(填”>”“< “或”=“);
②某温度下,将2 mol CO和6 mol H2充入2 L 的密闭容器中,充分反应后,达到平衡时测得c(CO)=
0.2 mol L1,则CO的转化率为_______,此时的温度为______________。
(3)要提高CO的转化率,可以采取的措施是_______。
a.升温 b.加入催化剂
c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
(4)300 °C,一定的压强下,5mol CO与足量H2在催化剂的作用下恰好完全反应变化的热量为454kJ。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol CO、 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH |
平衡时数据 | CH3OH的浓度 / (mol L1) | c1 | c2 | c3 |
反应的能量变化 | a kJ | b kJ | c kJ |
体系压强/ Pa | p1 | p2 | p3 |
反应物的转化率 | α1 | α2 | α3 |
下列说法正确的是_________。
A.2 c1>c3 B.a+b<90.8
C.2p2 <p3 D.α1 +α3<l
(5)为了寻找合成甲醇的温度和压强的适宜条件, 某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T/℃ | n(CO)/n(H2) | p/MPa |
1 | 150 | 1/3 | 0.1 |
2 | a | 1/3 | 5 |
3 | 350 | b | 5 |
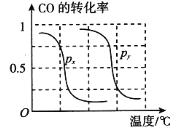
①则上表中剩余的验条件数据a=_________,b=_________。
②根据反应的特点,上图是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px=_________MPa。

 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案


