题目内容
8.硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4•(NH4)2SO4•6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如下表:| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
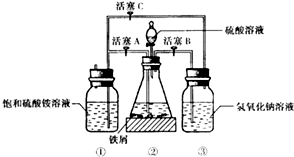
回答下列问题:
Ⅰ.(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS等),再用清水洗净.用氢氧化钠溶液煮沸的目的是除去铁屑中油污
(2)将处理好的铁屑放人锥形瓶中,加入稀硫酸.锥形瓶中发生反应的离子方程式可能为ABCD(填序号).
A.Fe+2H+═Fe2++H2↑
B.Fe2O3+6H+═2Fe3++3H2O
C.2Fe3++S2-═2Fe2++S↓
D.2Fe3++Fe═3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞A,打开活塞BC (填字母).容器③中NaOH溶液的作用是吸收硫化氢气体,防止污染空气;向容器①中通人氢气的目的是防止亚铁离子被氧气氧化.
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是硫酸亚铁铵的溶解度最小;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是过滤、用酒精洗涤、干燥.
Ⅲ.制得的硫酸亚铁铵晶体中往往含有极少量的Fe3+.为测定晶体中Fe2+的含量,称取一份质量为20.0g的硫酸亚铁铵晶体样品,制成溶液.用0.5mo1•L-1KMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO-4被还原成Mn2+时,耗KMnO4溶液体积20.00mL.
滴定时,将KMnO4溶液装在酸式(酸式或碱式)滴定管中,判断反应到达滴定终点的现象为溶液刚出现紫红色,保持30s不变;晶体中FeSO4的质量分数为38%.
分析 Ⅰ.(1)氢氧化钠溶液在加热条件下能使油污发生水解;
(2)铁屑中含有铁锈(Fe2O3)、FeS等,都与硫酸发生反应,反应后的产物Fe3+与S2-、Fe2+也可以发生氧化还原反应;
(3)亚铁离子能被空气中的氧气氧化,氢氧化钠溶液能吸收含杂质的铁屑与硫酸反应产生的硫化氢气体,防止污染空气;
Ⅱ.在溶液中溶解度小的物质先析出;从溶液中析出的硫酸亚铁铵晶体表面有硫酸、水等杂质,需要除杂、干燥;
Ⅲ.KMnO4溶液有强氧化性,容易氧化橡皮;高锰酸钾溶液滴入亚铁盐溶液中,高锰酸钾溶液会褪色,如果高锰酸钾溶液的颜色不褪色说明加入的高锰酸钾溶液已经足量,据此电子得失守恒得关系式5FeSO4~KMnO4,可以计算出FeSO4的质量,再根据$\frac{FeSO4的质量}{样品的质量}$×100%得到晶体中FeSO4的质量分数.
解答 解:Ⅰ.(1)氢氧化钠溶液在加热条件下能使油污发生水解,所以用氢氧化钠溶液煮沸的目的是除去铁屑中油污,
故答案为:除去铁屑中油污;
(2)铁屑中含有铁锈(Fe2O3)、FeS等,都与硫酸发生反应,反应后的产物Fe3+与S2-、Fe2+也可以发生氧化还原反应,
故选:ABCD;
(3)亚铁离子能被空气中的氧气氧化,所以要通入氢气,排除空气,防止亚铁离子被氧气氧化,氢氧化钠溶液能吸收含杂质的铁屑与硫酸反应产生的硫化氢气体,防止污染空气,所以利用容器②的反应,向容器①中通入氢气,应先将气体通过氢氧化钠溶液,再通入容器①,所以应关闭活塞A,打开活塞BC,
故答案为:A;BC;吸收硫化氢气体,防止污染空气;防止亚铁离子被氧气氧化;
Ⅱ.根据表中的数据可知,硫酸亚铁、硫酸铵、硫酸亚铁铵三种物质中,硫酸亚铁铵的溶解度最小,所以硫酸亚铁铵在溶液中先析出,从溶液中析出的硫酸亚铁铵晶体表面有硫酸、水等杂质,需要除杂、干燥,所以从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是过滤、用酒精洗涤、干燥,
故答案为:硫酸亚铁铵的溶解度最小;过滤;用酒精洗涤;干燥;
Ⅲ.KMnO4溶液有强氧化性,容易氧化橡皮,所以将KMnO4溶液装在酸式滴定管中,高锰酸钾溶液滴入亚铁盐溶液中,高锰酸钾溶液会褪色,如果高锰酸钾溶液的颜色不褪色说明加入的高锰酸钾溶液已经足量,所以反应到达滴定终点的现象为溶液刚出现紫红色,保持30s不变,据此电子得失守恒得关系式5FeSO4~KMnO4,可以计算出FeSO4的质量为5×0.5mo1•L-1×0.02L×152g/mol=7.6g,所以FeSO4的质量分数=$\frac{FeSO4的质量}{样品的质量}$×100%=$\frac{7.6}{20}$×100%=38%,
故答案为:酸式;溶液刚出现紫红色,保持30s不变;38%.
点评 本题以莫尔盐的制备为载体,考察氧化还原反应、氧化还原反应滴定应用、物质分离提纯等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目有一定的难度,注意基础知识的全面掌握.

| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA | |
| B. | 4℃时,18g2H216O中含有共用电子对数为2NA | |
| C. | 用金属铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA | |
| D. | 1mol N5+含有的电子数为34NA |
CH3CH2CH2COOH+
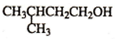 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$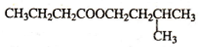 +H20
+H20| 相对分子质量 | 密度(g/cm3) | 沸点(℃) | 水中溶解性 | |
| 正丁酸 | 88 | 0.9587 | 163.5 | 溶 |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 丁酸异戊酯 | 158 | 0.886 | 179 | 不溶 |
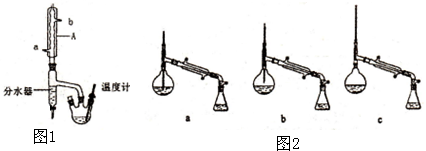
实验步骤:
①如图1连接好装置,在三颈烧瓶中加入0.2mol异戊醇和0.1mol正丁酸、数滴浓硫酸、5mL苯和2~3片碎瓷片,充分摇匀,分水器内加入异戊醇直至与支管相平;
②在122~132℃下回流反应1.5h即可得粗产品;
③冷却后用10%的NaOH溶液中和,用水洗至中性,加入无水硫酸镁后蒸馏得较纯净的丁酸异戊酯11g.
回答下列问题:
(1)图1中A仪器的名称是球形冷凝管或冷凝管,冷却水应从a(选择a或b)口进.
(2)在该实验中,三颈烧瓶的容积最适合的是B(填入正确选项前的字母).
A、50mL B、100mL C、200mL
(3)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是A(填入正确选项前的字母).
A、冷却后补加 B、立即补加 C、不需补加 D、重新配料
(4)加入过量异戊醇的目的是提高正丁酸的转化率,分离提纯过程中加入无水硫酸镁的目的是干燥.
(5)如图2,在蒸馏得较纯净的丁酸异戊酯操作中,仪器选择及安装都正确的是c(填标号).
(6)本实验的产率是69.6%.(保留三位有效数字)
| A. | 改善性能,增大用途 | |
| B. | 除去硫、磷和过多的碳,调整合金元素的含量 | |
| C. | 副产磷肥、水泥等 | |
| D. | 用红棕色炉气制取水煤气 |
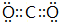 ,B与D形成的原子个数比为1:1的化合物的电子式是
,B与D形成的原子个数比为1:1的化合物的电子式是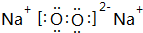 .
.
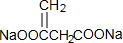 +NaCl+3H2O.
+NaCl+3H2O.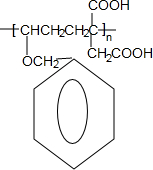 .
.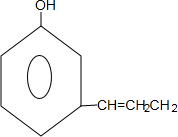 .
.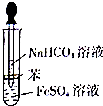 某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按右图所示操作将NaHCO3溶液滴加到FeS04溶液中(FeS04和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.
某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按右图所示操作将NaHCO3溶液滴加到FeS04溶液中(FeS04和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.