题目内容
3.核磁共振氢谱是测定有机分子结构最有用的工具之一.在有机物分子中,不同的氢原子在核磁共振氢谱中给出的峰值(信号)不同.根据峰值(信号)可以确定有机物中氢原子的种类.下列有机物分子中,在核磁共振氢谱中只给出一种峰(信号)的是( )| A. | CH3OH | B. | C(CH3)4 | C. | CH3COOH | D. | CH3COOCH3 |
分析 核磁共振氢谱中峰值数等于有机物中氢原子的种类数.核磁共振氢谱中只给出一种峰,说明该分子中的H原子都是等效的,只有1种H原子.
解答 解:A.CH3OH中有2种H原子,核磁共振氢谱中有2个峰,故A错误;
B.C(CH3)4中H原子都是等效的,核磁共振氢谱中只给出一种峰,故B正确;
C.CH3COOH中有2种H原子,核磁共振氢谱中有2个峰,故C错误;
D.CH3COOCH3中有2种H原子,核磁共振氢谱中有2个峰,故D错误.
故选B.
点评 本题考查核磁共振氢谱与有机物中氢原子的种类关系,难度较小,清楚核磁共振氢谱中峰值数等于有机物中氢原子的种类数.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.根据所学的知识和经验,判断下列变化在常温下的焓变,熵变及方向性,填表.
| 变化 | △H | △S | 方向性 |
| H2O(l)→H2O(g) | |||
| CaO(s)+SO2(g)═CaSO3(s) | |||
| 2Fe3+(aq)+Cu(s)═2Fe2+(aq)+Cu2+(aq) | |||
| NH4Cl(s)═HCl(g)+NH3(g) |
14.下列说法中正确的是( )
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在吸热反应中,反应物的总能量高于生成物的总能量 | |
| D. | 需要加热的化学反应一定是放热反应 |
11.电离度表示电解质的相对强弱,电离度的定义:
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%.
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1mol•L-1)如表:(已知H2SO4第一步电离是完全的)
(1)根据题意,请写出向硫酸溶液中滴加足量氢氧化钡溶液反应的离子反应方程式H++HSO4-+Ba2++2OH-=BaSO4+2H2O
(2)25℃时,0.1mol•L-1上述几种溶液中,c(H+)从大到小的顺序是ADBC(填序号);
(3)25℃时,0.1mol•L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1mol•L-1硫酸氢钠溶液中HSO4-的电离度,其原因是H2SO4=H++HSO4-,硫酸第一步电离的H+对第二步电离有抑制作用,HSO4-?H++SO42-使平衡向左移动,即电离度小于硫酸氢钠溶液中HSO4-的电离度.
(4)醋酸的电离平衡常数K的表达式是K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,醋酸的电离平衡常数K与电离度α的关系式为:K=$\frac{0.1{α}^{2}}{1-α}$(用含α的代数式表示)
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%.
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1mol•L-1)如表:(已知H2SO4第一步电离是完全的)
| 编号 | 物质(微粒) | 电离度α |
| A | 硫酸溶液(第一步完全电离):第二步 HSO4-?H++SO42- | 10% |
| B | 硫酸氢钠溶液:HSO4-?H++SO42 | 29% |
| C | 醋酸:CH3COOH?CH3COO-+H+ | 1.33% |
| D | 盐酸:HCl=H++Cl- | 100% |
(2)25℃时,0.1mol•L-1上述几种溶液中,c(H+)从大到小的顺序是ADBC(填序号);
(3)25℃时,0.1mol•L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1mol•L-1硫酸氢钠溶液中HSO4-的电离度,其原因是H2SO4=H++HSO4-,硫酸第一步电离的H+对第二步电离有抑制作用,HSO4-?H++SO42-使平衡向左移动,即电离度小于硫酸氢钠溶液中HSO4-的电离度.
(4)醋酸的电离平衡常数K的表达式是K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,醋酸的电离平衡常数K与电离度α的关系式为:K=$\frac{0.1{α}^{2}}{1-α}$(用含α的代数式表示)
8.已知R2+离子核外有a个电子,b个中子.表示R原子符号正确的是( )
| A. | ${\;}_{b}^{a}R$ | B. | ${\;}_{a-2}^{a+b-2}R$ | C. | ${\;}_{a+2}^{a+b+2}R$ | D. | ${\;}_{a-2}^{a+b}R$ |
4.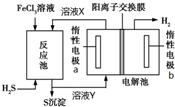 利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示.下列有关的说法错误的是( )
利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示.下列有关的说法错误的是( )
 利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示.下列有关的说法错误的是( )
利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示.下列有关的说法错误的是( )| A. | 惰性电极a为发生氧化反应 | |
| B. | Fe(OH)3胶体中滴加溶液X,先有沉淀后沉淀溶解 | |
| C. | 溶液Y加热蒸发灼烧最终得到Fe2O3 | |
| D. | 电解池总反应的离子方程式为2Fe2++2H+$\frac{\underline{\;电解\;}}{\;}$2Fe3++H2↑ |
 (1)写出电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑
(1)写出电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑