题目内容
3.写出下列反应的化学方程式或离子方程式:(1)铝与氢氧化钠溶液反应的离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑
(2)过氧化钠与水反应的离子方程式:2Na2O2+2H2O═4Na++4OH-+O2↑
(3)磁铁矿(Fe3O4)与盐酸反应的离子方程式:Fe3O4+8H+=2Fe3++Fe2++4H2O
(4)除去Na2CO3固体中混有的NaHCO3的化学方程式:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
(5)除去NaHCO3溶液中混有的Na2CO3离子方程式:CO32-+H2O+CO2=2HCO3-.
分析 (1)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
(2)过氧化钠与水反应生成氢氧化钠和氢气
(3)磁铁矿(Fe3O4)与盐酸反应生成氯化亚铁、氯化铁和水:
(4)除去Na2CO3固体中混有的NaHCO3,可以通过加热的方式完成:
(5)除去NaHCO3溶液中混有的Na2CO3,可以通入过量的二氧化碳气体完成.
解答 解:(1)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(2)过氧化钠与水反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O═4Na++4OH-+H2↑;
(3)Fe3O4与盐酸反应生成氯化亚铁、氯化铁和水,反应的离子方程式为:Fe3O4+8H+=2Fe3++Fe2++4H2O,
故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
(4)除去Na2CO3固体中混有的NaHCO3,碳酸氢钠易分解,可以通过加热的方法完成,反应的化学方程式为:2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(5)碳酸钠与过量二氧化碳反应生成碳酸氢钠,除去NaHCO3溶液中混有的Na2CO3,可以通入过量的二氧化碳,反应的离子方程式为:CO32-+H2O+CO2=2HCO3-,
故答案为:CO32-+H2O+CO2=2HCO3-.
点评 本题考查了离子方程式的书写,题目难度不大,明确发生反应的实质为解答关键,注意掌握离子方程式的书写原则,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

| A. | 2.5mol | B. | 5mol | C. | 25mol | D. | 250mol |
| A. | CH3OH | B. | C(CH3)4 | C. | CH3COOH | D. | CH3COOCH3 |
| CH3COOH?CH3COO-+H+ | |||
| 平衡移动方向 | c(H+) | 导电能力 | |
| (1)加水稀释 | |||
| (2)滴加浓盐酸 | |||
| (3)加NaOH | |||
| (4)加醋酸铵 | |||
| (5)升高温度 | |||
| A. | Al3+、Ag+、NO${\;}_{3}^{-}$、Cl- | B. | Mg2+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、Cl- | ||
| C. | Ba2+、K+、S2-、Cl- | D. | Fe2+、Na+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ |
| A. | 瓶塞正放在桌面上 | B. | 试管稍微倾斜 | ||
| C. | 标签朝向手心 | D. | 瓶口紧挨试管口 |
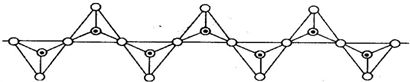
| A. | 1:3 | B. | 1:4 | C. | 2:5 | D. | 2:7 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
 .
.