题目内容
15. (1)写出电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑
(1)写出电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑(2)用如图所示装置电解500mL2mol•L-1食盐水可制取一种消毒液,在通电过程中不断搅拌溶液(使阳极产物全部溶解在溶液中)溶液的pHA(填写字母)
A.逐渐增大;
B.逐渐减小;
C.保持不变
当阳极有氧气生成时,停止通电最终所得溶液中的溶质主要成分是NaClO;
假设电解过程中阳极产物无逸出,溶液加水至500mL,消毒液的浓度是2mol•L-1
(3)向上述制取的消毒液中通入CO2气体,可以增强消毒效果,写出反应的离子方程式2ClO-+CO2+H2O=2HClO+CO32-.
分析 (1)电解饱和食盐水,溶液中的氯离子在阳极失电子生成氯气,氢离子在阴极得到电子生成氢气,据此书写离子方程式;
(2)根据电解饱和食盐水的离子方程式判断溶液的pH逐渐增大;阳极产物全部溶解在溶液中,说明生成的氯气与氢氧根反应生成NaClO和NaCl,又当阳极有氧气生成时,即氯离子放电完全,则溶液中的溶质主要成分是NaClO;根据氯原子守恒结合c=$\frac{n}{V}$计算;
(3)向上述制取的消毒液中通入CO2气体,利用碳酸酸性比次氯酸强书写方程式.
解答 解:(1)电解饱和食盐水,溶液中的氯离子在阳极失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大生成氢氧化钠,反应的离子方程式:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
(2)因为电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,所以溶液的pH逐渐增大;
因为阳极产物全部溶解在溶液中,说明生成的氯气与氢氧根反应生成NaClO和NaCl,又阳极有氧气生成时,即氯离子放电完全,则溶液中的溶质主要成分是NaClO;
根据氯原子守恒,则NaClO的物质的量为0.500L×2mol•L-1=1mol,所以c=$\frac{n}{V}$=$\frac{1mol}{0.5L}$=2mol•L-1;
故答案为:A;NaClO; 2;
(3)因为碳酸酸性比次氯酸强,所以向上述制取的消毒液中通入CO2气体发生的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-;故答案为:2ClO-+CO2+H2O=2HClO+CO32-.
点评 本题考查了电解池原理的分析应用,主要是电解反应以及相关计算,题目难度中等.

①混合物:石炭酸、福尔马林、水玻璃、水银
②化合物:CaCl2、烧碱、苯乙烯、HD
③电解质:明矾、冰醋酸、硫酸钡
④纯净物:干冰、冰水混合物、浓硫酸、水晶
⑤同素异形体:足球烯、石墨、金刚石
⑥同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2.
| A. | ①②③④ | B. | ②④⑤⑥ | C. | ①③④⑤ | D. | ①②④⑥ |
| A. | 摩尔是用来衡量微观粒子多少的一种物理量 | |
| B. | 标况下O2的体积取决于O2分子间的距离 | |
| C. | 常温常压下4.9LO3含有的O约为9.6g | |
| D. | 若气体摩尔体积为22.4 L/mol,则所处条件为标准状况 |
| A. | CH3OH | B. | C(CH3)4 | C. | CH3COOH | D. | CH3COOCH3 |
| A. | 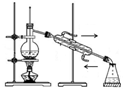 石油分馏 | B. |  灼烧干海带 | C. |  分离汽油和水 | D. |  冶炼金属铁 |
| CH3COOH?CH3COO-+H+ | |||
| 平衡移动方向 | c(H+) | 导电能力 | |
| (1)加水稀释 | |||
| (2)滴加浓盐酸 | |||
| (3)加NaOH | |||
| (4)加醋酸铵 | |||
| (5)升高温度 | |||
| A. | Al3+、Ag+、NO${\;}_{3}^{-}$、Cl- | B. | Mg2+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、Cl- | ||
| C. | Ba2+、K+、S2-、Cl- | D. | Fe2+、Na+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ |
| A. | 瓶塞正放在桌面上 | B. | 试管稍微倾斜 | ||
| C. | 标签朝向手心 | D. | 瓶口紧挨试管口 |
 向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )
向10.0mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体逸出),下列有关叙述正确的是( )| A. | M-N间一定存在c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | M点对应的盐酸体积为10.0mL | |
| C. | pH=7溶液中有c(NH4+)=c(Cl-)=c(H+)=c(OH-) | |
| D. | P点处的溶液中存在:2c(NH4+)+2c(NH3•H2O)=c(Cl-) |