��Ŀ����
����Ŀ����������к���Cr��OH��3��Al2O3��ZnO��CuO��NiO�����ʣ���ҵ��ͨ���������̻���Na2Cr2O7�����ʣ� 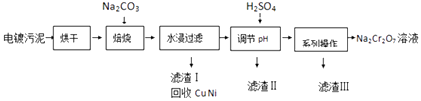
��֪��
��Cr��OH��3��ZnO��Al2O3һ����Ϊ���Ի����
��Na2Cr2O7��Na2SO4�ڲ�ͬ�¶��µ��ܽ�������
20�� | 60�� | 100�� | |
Na2SO4 | 19.5 | 45.3 | 42.5 |
Na2Cr2O7 | 183 | 269 | 415 |
��1�����չ���������Na2CrO4�Ļ�ѧ����ʽΪ��ˮ������Һ�г�Na2CrO4�����ڵ�����������
��2������H2SO4����pH��Ŀ��Ϊ��
��3���õ�������ġ�ϵ�в������IJ���Ϊ�����ˣ�
��4����1L����H2SO4��������Һ�к���Ԫ������Ϊ23.4g��CrO42����8/9ת��ΪCr2O72�� �� ��ת����������Һ��c��Cr2O72����=molL��1��
��5����Na2Cr2O7��H2SO4���Һ�м���H2O2 �� �ټ������Ѳ�ҡ�������Ѳ�Ϊ��ɫ������������CrO5 �� ������Ӧ�Ļ�ѧ����ʽΪ ��
���𰸡�
��1��4Cr��OH��3+4Na2CO3+3O2 ![]() 4Na2CrO4+6H2O+4CO2��NaAlO2��Na2ZnO2
4Na2CrO4+6H2O+4CO2��NaAlO2��Na2ZnO2
��2����ȥ��Һ��NaAlO2��Na2ZnO2���ʣ�����CrO42��ת��ΪCr2O72��
��3������Ũ������ȴ�ᾧ
��4��0.2
��5��Na2Cr2O7+4H2O2+H2SO4�T2CrO5+Na2SO4+5H2O
���������⣺��1����������ķ�����֪������������̼�����������������±������ɸ����ƣ���Ӧ�Ļ�ѧ����ʽΪ4Cr��OH��3+4Na2CO3+3O2 ![]() 4Na2CrO4+6H2O+4CO2 �� ���պ�Ĺ�����Na2CrO4��Na2ZnO2��NaAlO2������ˮ������ˮ������Һ�е����ʳ�Na2CrO4������ NaAlO2��Na2ZnO2 �� ���Դ��ǣ�4Cr��OH��3+4Na2CO3+3O2
4Na2CrO4+6H2O+4CO2 �� ���պ�Ĺ�����Na2CrO4��Na2ZnO2��NaAlO2������ˮ������ˮ������Һ�е����ʳ�Na2CrO4������ NaAlO2��Na2ZnO2 �� ���Դ��ǣ�4Cr��OH��3+4Na2CO3+3O2 ![]() 4Na2CrO4+6H2O+4CO2�� NaAlO2��Na2ZnO2����2��ˮ������Һ�д���Na2CrO4 �� �������ᷢ��CrO42��+2H+Cr2O72��+H2O��NaAlO2��Na2ZnO2���ᷴӦ�����Գ�ȥ��Һ��NaAlO2��Na2ZnO2���ʣ�����CrO42��ת��ΪCr2O72�� ��
4Na2CrO4+6H2O+4CO2�� NaAlO2��Na2ZnO2����2��ˮ������Һ�д���Na2CrO4 �� �������ᷢ��CrO42��+2H+Cr2O72��+H2O��NaAlO2��Na2ZnO2���ᷴӦ�����Գ�ȥ��Һ��NaAlO2��Na2ZnO2���ʣ�����CrO42��ת��ΪCr2O72�� ��
���Դ��ǣ���ȥ��Һ��NaAlO2��Na2ZnO2���ʣ�����CrO42��ת��ΪCr2O72������3���������м������������ظ����ƺ������ƣ����Եõ�������ӦΪ�����ƣ������������ʵ��ܽ�����¶ȵĹ�ϵ��֪�ظ����Ƶ��ܽ�Ƚϴ������Ƶ��ܽ�Ƚ�С�����Եõ������������ƵIJ���Ϊ ����Ũ������ȴ�ᾧ�����ˣ�
���Դ��ǣ�����Ũ������ȴ�ᾧ����4����1L����H2SO4��������Һ�к���Ԫ������Ϊ23.4g���������ʵ���Ϊ ![]() =0.45mol��CrO42����8/9ת��ΪCr2O72�� �� ������Һ��n��Cr2O72����=0.45mol��
=0.45mol��CrO42����8/9ת��ΪCr2O72�� �� ������Һ��n��Cr2O72����=0.45mol�� ![]() =��
=�� ![]() 0.2 mol������Һ��c��Cr2O72����=0.2molL��1 ��
0.2 mol������Һ��c��Cr2O72����=0.2molL��1 ��
���Դ��ǣ�0.2����5��Na2Cr2O7��H2O2 �� �����������·�Ӧ����CrO5 �� ��Ӧ�Ļ�ѧ����ʽΪNa2Cr2O7+4H2O2+H2SO4�T2CrO5+Na2SO4+5H2O��
���Դ��ǣ�Na2Cr2O7+4H2O2+H2SO4�T2CrO5+Na2SO4+5H2O��

 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�����Ŀ�����к͵ζ����ⶨ�ռ�Ĵ��ȣ����ռ��к��������Ӧ�����ʣ��Ը���ʵ��ش�
(1)��ȷ�����õ�2.0 g�ռ���Ʒ���100mL����Һ����Ҫ����Ҫ������������Ͳ���ձ����������⣬�������õ���������_______��________________��
(2)�ü�ʽ�ζ�����ȡ10.00mL����Һ��������ƿ�У�ͬʱ�μ�1-2��ָʾ������ѧ�ϳ�ѡ�õ�ָʾ���з�̪��____________��
(3)��0.2010mol��L-1������ζ������ռ���Һ���ζ�ʱ������ת��ʽ�ζ��ܵIJ������������ֲ�ͣ��ҡ����ƿ������ע��__________________��ֱ���ζ����յ㣬��ѡ���̪��Ϊָʾ�����жϵζ��յ�ı�־��___________________________��
(4)�����������ݣ����c��NaOH��=________���ռ�Ĵ���=____________��
�ζ� ���� | ����Һ��� (mL) | �����������mL�� | |
�ζ�ǰ������mL�� | �ζ��������mL�� | ||
��һ�� | 10.00 | 0.50 | 20.40 |
�ڶ��� | 10.00 | 4.00 | 24.10 |
������ | 10.00 | 1.00 | 24.10 |
��5���Ա���������Һ�ζ�δ֪Ũ�ȵ�����������Һ�����в����������ҺŨ��ƫС���� _______________(�����)��
�ٶ������ζ�ǰƽ�ӣ��ζ����Ӣ�δ�ô���Һ��ϴ��ʽ�ζ���
���ô���Һ��ϴ��ƿ�ܲ�С�Ľ���Һ������ƿ����
�ݵζ��ӽ��յ�ʱ������������ˮ��ϴ��ƿ�ڱ�
����Ŀ��Fenton�������ڴ������ѽ����л���Ĺ�ҵ��ˮ��ͨ�����ڵ��ں�pH��Fe2+Ũ�ȵķ�ˮ�м���H2O2 �� ���������ǻ����ɻ�������������Ⱦ������ø÷��������л���Ⱦ��p��CP��̽���й����ضԸý��ⷴӦ���ʵ�Ӱ�죮[ʵ�����]����p��CP�ij�ʼŨ����ͬ���㶨ʵ���¶���298K��313K������ʵ���������±�����������¶Ա����飮
��1�����������ʵ����Ʊ������в�Ҫ���ո�
ʵ���� | ʵ��Ŀ�� | T/K | pH | c/10��3molL��1 | |
H2O2 | Fe2+ | ||||
�� | Ϊ����ʵ�����ο� | 298 | 3 | 6.0 | 0.30 |
�� | ̽���¶ȶԽ��ⷴӦ���ʵ�Ӱ�� | ||||
�� | 298 | 10 | 6.0 | 0.30 | |
��2��[���ݴ���]ʵ����p��CP��Ũ����ʱ��仯�Ĺ�ϵ��ͼ��
�������ͼʵ������ߣ����㽵�ⷴӦ��50��150s�ڵķ�Ӧ���ʣ�v��p��CP��= ��
��3��[���������]ʵ��١��ڱ����¶����ߣ����ⷴӦ���������¶ȹ���ʱ�������½��ⷴӦ���ʼ�С�����Fenton�������Լ�H2O2�ĽǶȷ���ԭ�� ��
��4��ʵ��۵ó��Ľ����ǣ�pH����10ʱ�� ��
��5���������⣺��һ��������H2O2��Fe2+�����ӷ�Ӧʽ ��