题目内容
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol/L的NaOH溶液,乙为0.1 mol/L的HCl溶液,丙为0.1 mol/L的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=__________。
(2)丙溶液中存在的电离平衡为______________(用电离方程式表示)。
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为__________________。
(4)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL 丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
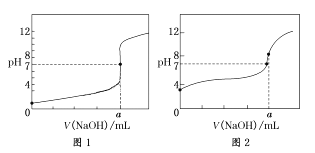
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”);
②a=_______ mL,此时丙溶液中的质子守恒关系式为_____________________________。
【答案】 13 CH3COOH![]() CH3COO-+H+、H2O
CH3COO-+H+、H2O![]() OH-+H+ 丙>甲=乙 图2 20.00 c(CH3COOH) + c(H+) = c(OH-)
OH-+H+ 丙>甲=乙 图2 20.00 c(CH3COOH) + c(H+) = c(OH-)
【解析】(1)0.1molL-1的NaOH溶液中c(OH-)=0.1mol/L,故溶液中c(H+)=![]() mol/L=10-13mol/L,故该溶液的pH=-lg10-13=13,故答案为:13;
mol/L=10-13mol/L,故该溶液的pH=-lg10-13=13,故答案为:13;
(2)0.1molL-1的CH3COOH溶液中存在溶剂水、水为弱电解质,溶质乙酸为弱电解质,存在电离平衡为CH3COOHCH3COO-+H+、H2OOH-+H+,故答案为:CH3COOHCH3COO-+H+;H2OOH-+H+;
(3)酸或碱抑制水电离,含有弱根离子的盐促进水电离,乙酸是弱电解质,氢氧化钠、氯化氢是强电解质,所以相同物质的量浓度的乙酸和盐酸和氢氧化钠,盐酸中水电离出的氢氧根离子浓度小于醋酸,相同物质的量浓度的盐酸和氢氧化钠对水电离抑制程度相等,盐酸中水电离出的氢氧根离子浓度等于氢氧化钠溶液中水的电离,所以水电离出氢氧根离子浓度大小顺序是:丙>甲=乙,故答案为:丙>甲=乙;
(4)①醋酸为弱电解质,滴定过程中pH变化较盐酸缓慢,滴定终点时溶液呈碱性,则滴定醋酸溶液的曲线是图2,故答案为:图2;
②滴定终点时n(CH3COOH)=n(NaOH),则a=20.00mL,反应生成了醋酸钠,醋酸根离子发生水解,CH3COO-+H2OCH3COOH+OH-,溶液显示碱性pH>7,溶液中的质子守恒关系式为c(CH3COOH) + c(H+) = c(OH-),故答案为:20.00;c(CH3COOH) + c(H+) = c(OH-)。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案【题目】电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过下述流程回收Na2Cr2O7等物质. 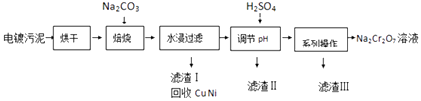
已知:
①Cr(OH)3、ZnO和Al2O3一样均为两性化合物;
②Na2Cr2O7、Na2SO4在不同温度下的溶解度如表:
20℃ | 60℃ | 100℃ | |
Na2SO4 | 19.5 | 45.3 | 42.5 |
Na2Cr2O7 | 183 | 269 | 415 |
(1)焙烧过程中生成Na2CrO4的化学方程式为;水浸后溶液中除Na2CrO4还存在的溶质有和;
(2)加入H2SO4调节pH的目的为;
(3)得到滤渣Ⅲ的“系列操作”的步骤为、过滤;
(4)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g,CrO42﹣有8/9转化为Cr2O72﹣ , 求转化后所得溶液中c(Cr2O72﹣)=molL﹣1;
(5)向Na2Cr2O7与H2SO4混合液中加入H2O2 , 再加入乙醚并摇动,乙醚层为蓝色.乙醚中溶有CrO5 , 则发生反应的化学方程式为 .