题目内容
18.10mL浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响生成氢气总量的是( )| A. | CH3COONa | B. | KNO3 | C. | CuSO4 | D. | NaHCO3 |
分析 根据反应的实质为Zn+2H+═Zn2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,注意Zn过量,以此来解答.
解答 解:A.加入CH3COONa溶液,溶液被稀释,且醋酸根与溶液中氢离子结合为醋酸分子,溶液中氢离子降低,且提供的氢离子总量不变,故能减慢反应速率且又不影响氢气生成量,故A正确;
B、加入硝酸钾,硝酸根离子在酸性环境中与Zn反应生成氮的氧化物,而不是氢气,故B错误;
C.Zn可以置换出Cu,构成原电池,加快反应速率,故C错误;
D.加入碳酸氢钠溶液,与盐酸反应是二氧化碳,氢离子总量较小,生成氢气的量减少,故D错误,
故选A.
点评 本题考查化学反应速率影响因素,比较基础,需注意生成氢气的量不变,注意C选项构成原电池,加快反应速率.

练习册系列答案
相关题目
8.25℃,向20mL 0.1mol•L-1的H3PO2溶液中滴加0.1mol•L-1的NaOH溶液(滴定过程中溶液温度保持不变),滴定曲线如图1,含磷物种浓度所占分数(δ)随pH变化关系如图2,则下列说法不正确的是( )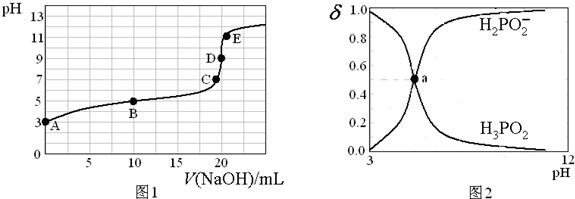

| A. | H3PO2的电离方程式为:H3PO2?H2PO2-+H+;电离常数Ka≈10-5 | |
| B. | B点溶液中存在关系:2c(H+)+c(H3PO2)=2c(OH-)+c(H2PO2-) | |
| C. | 图2中的a点对应为 图1中的B点 | |
| D. | D点时,溶液中微粒浓度大小关系为:c(Na+)>c(H2PO2-)>c(OH-)>c(H+) |
6.下列各种说法中正确的是( )
| A. | 乙烯和甲苯都能使酸性高锰酸钾溶液褪色 | |
| B. | 凡是能起银镜反应的物质一定是醛 | |
| C. | 在酯化反应中,羧酸脱去羧基中的氢原子,醇脱去羟基生成水和酯 | |
| D. | 苯酚有弱酸性,因此它是一种羧酸 |
13.下列实验能达到预期目的是( )
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
②往蛋白质溶液中加入CuSO4溶液可使蛋白质产生盐析
③用食醋和澄清石灰水验证蛋壳中含有碳酸盐
④直接往淀粉水解液中滴入银氨溶液可产生银镜
⑤用溴水检验汽油中是否含有不饱和烃
⑥用硝酸洗涤刚做完银镜反应的试管.
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
②往蛋白质溶液中加入CuSO4溶液可使蛋白质产生盐析
③用食醋和澄清石灰水验证蛋壳中含有碳酸盐
④直接往淀粉水解液中滴入银氨溶液可产生银镜
⑤用溴水检验汽油中是否含有不饱和烃
⑥用硝酸洗涤刚做完银镜反应的试管.
| A. | ①②③⑥ | B. | ①③④ | C. | ③⑤⑥ | D. | ②④⑤ |
10.下列说法正确的是( )
| A. | 石油的成分只有烷烃 | B. | 石油裂化的过程是物理变化 | ||
| C. | 石油分馏的产品汽油是纯净物 | D. | 石油分馏过程是物理变化 |
7.下列固体物质溶于水,再将其溶液加热、蒸发结晶、再灼烧,能得到化学组成与原固体物质相同的是( )
①胆矾 ②氯化铝 ③硫酸铝 ④Na2CO3 ⑤NaHCO3 ⑥高锰酸钾.
①胆矾 ②氯化铝 ③硫酸铝 ④Na2CO3 ⑤NaHCO3 ⑥高锰酸钾.
| A. | ③④ | B. | ①③④ | C. | ①②③④⑤ | D. | 全部 |
8.根据下列操作及现象,所得结论不正确的是( )
| 序号 | 操作及现象 | 结论 |
| A | 将0.1mol•L-1氨水稀释成0.01mol•L-1,测得pH由11.1变成 10.6 | 稀释后NH3•H2O的电离程度增大 |
| B | 常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液 | 常温下水解程度:CO32->HCO3- |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 明矾可用于净水 | 明矾在水中水解生成的氢氧化铝胶体有吸附性 |
| A. | A | B. | B | C. | C | D. | D |
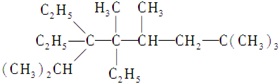 2,2,4,5,7,7-六甲基-3,3,4-乙基辛烷,
2,2,4,5,7,7-六甲基-3,3,4-乙基辛烷, 下列各物质:与麻黄素互为同分异构体的是DE(填字母)
下列各物质:与麻黄素互为同分异构体的是DE(填字母)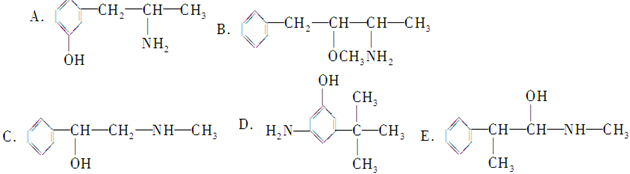
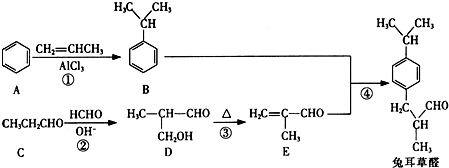
 (填结构简式)
(填结构简式)
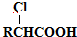 ,以物质C为原料制备聚乳酸(
,以物质C为原料制备聚乳酸(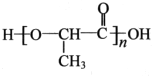 ),可通过四步反应制得,按反应顺序,这四步的反应类型依次是:氧化反应、取代反应、水解反应、缩聚反应.
),可通过四步反应制得,按反应顺序,这四步的反应类型依次是:氧化反应、取代反应、水解反应、缩聚反应.